自噬(autophagy)是依赖溶酶体途径对胞质蛋白和细胞器进行降解的一种过程,在进化上具有高度保守性。自噬通过降解受损的细胞器、错误折叠或有毒的蛋白质和病原体,维持细胞稳态,并促进细胞在压力下的存活。自噬与神经退化性疾病和癌症等人类多种疾病的发病机制有关,是二十一世纪以来生物学研究领域中的热点之一。
我院王任小研究员团队以蛋白-蛋白相互作用体系(protein-protein interaction)为靶标发展小分子调控剂,为创新药物发现提供新的机会。在过去几年中,该团队选择对自噬泡的延伸与自噬体的成熟至关重要的ATG5与ATG16L1形成的蛋白-蛋白相互作用体系为靶标,应用药物分子设计技术,发展可以调控该靶标体系生物功能的小分子活性化合物,近期取得关键性进展。阶段性成果以《Discovery of small-molecule autophagy inhibitors by disrupting the protein-protein interactions involving ATG5》为题,已在线发表于美国化学会出版的药物化学领域权威杂志Journal of Medicinal Chemistry(原文链接:https://doi.org/10.1021/acs.jmedchem.2c01233)。
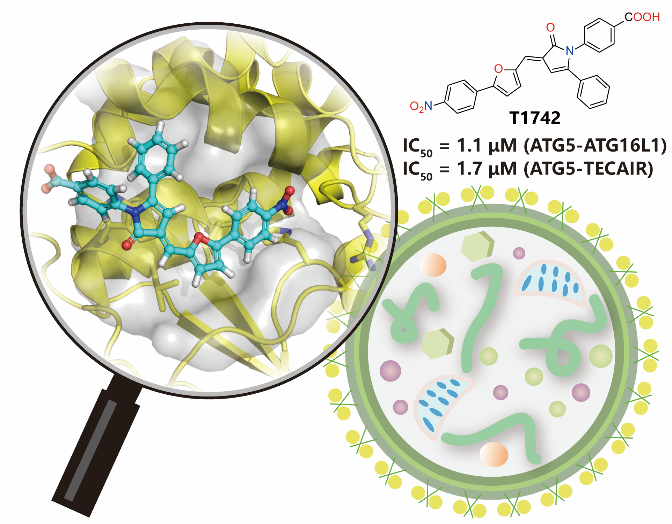
作者首先基于虚拟筛选发现了一种具有3-[(E)-呋喃-2-基甲亚基]-1H-吡咯-2-酮骨架的化合物T1742,该化合物在体外HTRF结合实验中可以阻断ATG5-ATG16L1和ATG5-TECAIR相互作用(IC50=1~2 μM),并在细胞流式和免疫印迹实验中也表现出对自噬的抑制效果。作者通过分子动力学模拟预测了T1742与ATG5可能的结合模式,并以此为指导合成了一批具有相同结构骨架的衍生物。这些新合成的化合物其靶蛋白亲合性实验结果和细胞流式实验的结果大体一致,证明了活性化合物的作用机制。该项研究工作在国际上首次获得了活性达到微摩尔级别的ATG5蛋白小分子抑制剂,证实了ATG5蛋白小分子抑制剂可以作为一类新的自噬抑制剂工具分子来探索自噬机制,也具备进一步发展成为候选药物的潜力。
本院药物化学系2020级博士研究生向洪刚、张翔鹰以及2018级博士研究生刘瑞齐为该论文的共同第一作者,本院药物化学系王任小研究员、李英霞教授和周璐教授为本文的共同通讯作者,在研究过程中得到了沈阳药科大学郭春教授课题组的帮助。该项研究工作获得国家自然科学基金和上海市科学技术委员会相关项目支持。


