近日,国际知名学术期刊《生物活性材料》(Bioactive Materials)在线发表了复旦大学药学院王建新教授团队题为《用于免疫原性化疗和肿瘤抗原特异性免疫治疗的载奥沙利铂纳米粒成熟树突状细胞衍生囊泡》(Mature dendritic cell-derived dendrosomes swallow oxaliplatin-loaded nanoparticles to boost immunogenic chemotherapy and tumor antigen-specific immunotherapy)的研究成果。该论文报道了一种树突状细胞(DC)仿生纳米制剂,可参与免疫化疗联合疗法,放大肿瘤免疫应答效应,具有显著的抗肿瘤效果。
基于DC全细胞疫苗的免疫疗法已被证明是最具开发潜力的肿瘤治疗方法之一,然而,细胞治疗伴随的生物安全风险,免疫系统中抗原刺激不足,以及肿瘤发生发展过程中的免疫抑制肿瘤微环境的形成,导致了其在临床应用中收益非常有限。该研究首先利用仿生纳米载体技术设计并构建了一种肿瘤抗原自递呈DC囊泡,这种功能化DC囊泡继承了亲代细胞的免疫刺激能力,又避免了体内安全风险。随后采用超声-挤出法,将负载奥沙利铂的纳米粒表面包裹上述肿瘤抗原致敏DC囊泡,从而得到靶向肿瘤的仿生纳米递送系统(NP/mDs)。NP/mDs被肿瘤细胞摄取后释放奥沙利铂可引发肿瘤细胞免疫原性死亡(ICD),同时释放肿瘤抗原和损伤相关分子模式(DAMPs)信号分子,招募DC对抗原加工递呈,产生免疫应答反应。位于NP/mDs外部的DC囊泡还可将自身抗原直接递呈给DC细胞和T细胞,诱导DC成熟和T细胞活化,发挥免疫刺激作用,协同增强肿瘤特异性免疫应答,该系统在CT26小鼠肿瘤模型上显示出良好的肿瘤治疗效果和安全性。联合PD-L1阻断治疗发现可进一步诱导T细胞充分活化,多管齐下,显著抑制了CT26肿瘤的增殖速率,建立长期免疫记忆,抑制了肿瘤的发生和转移。研究结果为肿瘤治疗的提供了一种新的策略。
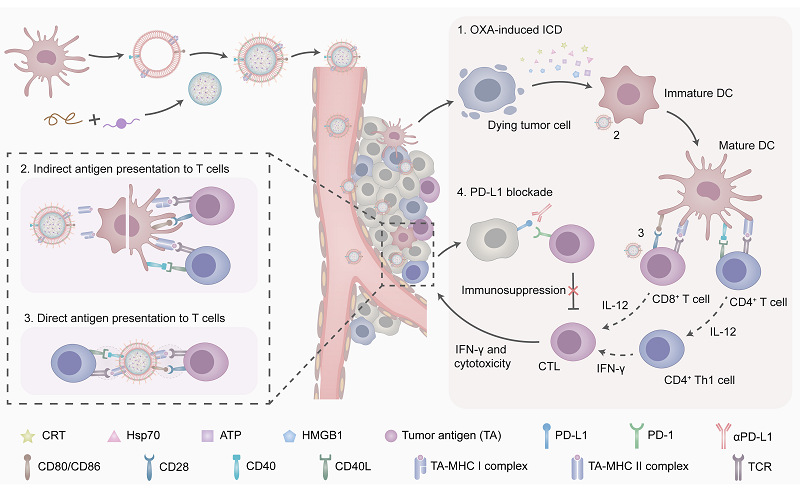
NP/mDs与肿瘤和免疫细胞相互作用重塑局部肿瘤微环境示意图
复旦大学药学院2018级博士研究生陈星为论文的第一作者,药学院王建新教授和华山医院放射科副主任医师尹波为论文的通讯作者。该研究获得国家自然科学基金重大项目(81690263)和国家自然科学基金面上项目(81773911)的支持。
原文链接: https://doi.org/10.1016/j.bioactmat.2021.12.020
王建新课题组介绍
王建新教授课题组成立于2005年,主要从事基于病理特征的靶向递药系统构建、口服给药系统研究、药物新剂型新制剂的开发等。已培养硕士研究生20名,博士研究生17名,现有在读硕士研究生5名、博士研究生12名。主持国家及省部级科研项目30余项,企业合作项目40余项。发表研究论文180余篇,包括Science Advances、ACS Nano、Nano-Micro Letters、JCR、APSB等SCI论文100余篇;获新药证书或临床批文14项,授权发明专利16项;主编《药剂学》、《生物药剂学与药物动力学》等教材与专著4部,副主编教材与专著6部,参编10部。
王建新教授目前主要社会兼职国家药品注册审评专家咨询委员会委员,中国药学会药剂专委会委员,中国药学会工业药剂学专委会委员,世界中医药学会联合会新型给药系统专业委员会常务理事兼秘书长,中国生物医学工程学会纳米医学与工程分会委员,中华中医药学会中药制剂分会常务理事,上海市药学会药剂专委会副主任委员等。



