阐释纳米载体递药系统(NDDSs)的体内时空命运对促进其临床转化具有重大意义。在众多NDDSs中,聚合物胶束(PMs)极为常见且性质独特。目前已有不少基于PMs的产品进入到临床研究阶段,但成功上市的产品数量仍不够理想。近期,复旦大学药学院吴伟课题组受邀在《Advanced Drug Delivery Reviews》杂志上发表题为“The in vivo fate of polymeric micelles”的综述,对聚合物胶束的体内命运进行了系统的分析,以期对PMs的处方优化与临床转化提供理论指导。论文的第一作者为复旦大学药学院直博生蔡毅范,何海生青年副研究员和吴伟教授为共同通讯作者。
PMs是一类由两亲性嵌段共聚物自组装形成的粒径普遍在10-100 nm之间的纳米载体,共聚物的亲水链与疏水链分别组成PMs的亲水“壳”与疏水“核”。该自组装过程具有动态平衡特性,平衡取决于体系中聚合物浓度与其临界胶束浓度(CMC)。PMs的制备十分简便,并且可通过改变共聚物的成分从而实现PMs理化性质的可控调节,如粒径、形状、电荷与靶向性等(图1)。
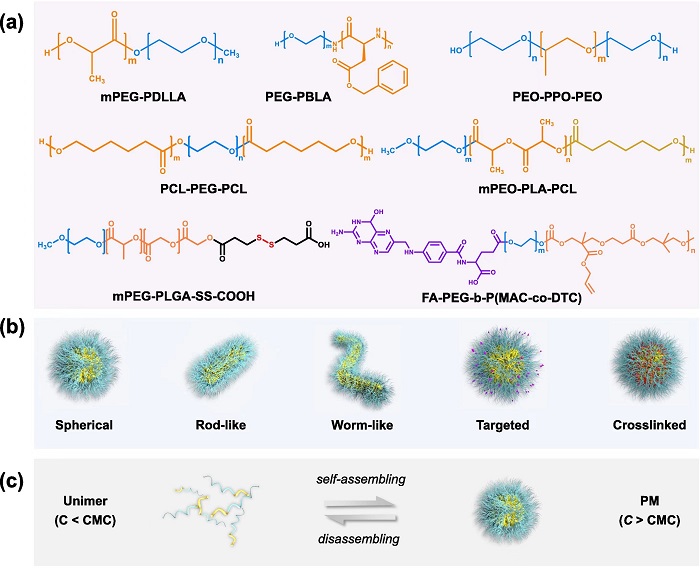
图1 PMs的组成与理化性质
该综述详细介绍了当前用于体内示踪PMs的主流策略,并对这些策略的优缺点进行了对比。随后全面介绍了PMs从进入体内开始,在体内与细胞中的不同过程,包括吸收、体内稳定性、胶束-血液成分相互作用、体内分布、体内降解与清除、药物释放、PMs-细胞膜相互作用以及胞内转运等。当前的研究表明:1)非静脉给药途径的PMs较难以完整粒子形式跨越生物屏障进入血液循环;2)尽管存在争议,进入血液中的PMs总体表现出较好的稳定性,但蛋白及其他血液成分的影响不可被忽略;3)PMs虽然具有亲水外壳且粒径较小,但仍无法逃逸单核吞噬细胞系统的吞噬作用;4)PMs的体内降解主要以共聚物单体形式的降解为主,而单体的降解会进一步促进PMs的解聚;5)PMs物理包载的药物在体内易发生突释或早释,主流观点将其归咎于体内血浆蛋白等多种复杂成分的影响;6)胶束与细胞膜的相互作用影响PMs的稳定性,而PMs本身的稳定性又会影响PMs进入胞内的路径;(7)改变PMs的粒径、表面电荷、疏水性、靶向修饰、形状与交联程度,会明显影响其体内的半衰期、生物分布、肿瘤蓄积、细胞摄取和胞内转运等。该综述对这些内容进行了全面的回顾和分析。
最后,作者总结了PMs等NDDSs体内命运研究当前所面临的挑战。尽管已有大量相关研究工作得以发表,但不少工作的结论并不一致,甚至相互矛盾。作者认为,开发高精准的示踪工具、区分粒子/药物/材料的体内行为、深入阐释PMs与体内蛋白成分的相互作用等有助于克服这样的困境,从而进一步阐明PMs的体内命运,加快PMs产品的临床转化。
原文链接:https://www.sciencedirect.com/science/article/pii/S0169409X22003532


