肿瘤转移是患者致死的最主要因素,以高侵袭性的三阴性乳腺癌为例,临床上90%以上的死亡为肿瘤转移造成,而传统的治疗手段,包括化疗、放疗和手术切除等仅能实现对原位肿瘤的控制,对于肿瘤转移无能为力,甚至在一定程度上会诱导免疫抑制和炎症反应,增加肿瘤转移的几率。因此有必要通过研究转移形成的机制,探寻新的思路抑制肿瘤转移。肿瘤转移是一个多步骤进程,主要包括三个阶段:(1)侵袭阶段:原位肿瘤细胞通过上皮细胞-间充质转化过程(EMT)增加自身侵袭性,侵袭至周围组织并迁徙至血管或淋巴管附近,穿出血管进入循环系统,成为循环肿瘤细胞(CTCs);(2)循环阶段:血小板直接黏附于CTCs表面,形成“细胞微栓”(Micro-thrombi)的结构,该结构能够减少免疫系统的识别和清除;(3)定植阶段:CTCs定植于远端器官的“前转移灶”(Pre-metastatic niche),其是指在原位肿瘤组织分泌的细胞因子或者外泌体的作用下形成的一种有利于肿瘤细胞定植的带有免疫抑制特征的炎性环境。然而现有的治疗策略通常只能针对肿瘤转移的某一阶段进行干预,对于肿瘤转移的整体过程缺乏有效的治疗策略。
近期,复旦大学药学院陈钧课题组开发了一种以内部包载抗炎小分子药物,外部搭载抗血栓药物为基础的新型磷酸钙脂质纳米结构,其能够有效干预肿瘤转移的各个阶段,相关成果以《全过程靶向肿瘤转移的纳米制剂增强手术切除和化疗的治疗效果》(“Systemic metastasis-targeted nanotherapeutic reinforces tumor surgical resection and chemotherapy”)为题,在线发表于国际权威期刊《自然-通讯》(Nature Communications)。
研究者首先将具有抗炎作用的低毒天然药物分子白皮杉醇合成为其磷酸化前药(Piceatannol phosphate, PP),通过反相微乳法将其制备成纳米沉淀核心,再通过薄膜水化法制备得到磷酸钙脂质体(CaPP),而后通过静电吸附作用在外侧搭载抗栓药物低分子量肝素(Low Molecular Weight Heparin, LMWH),最终得到全过程靶向肿瘤转移的纳米递送系统(H@CaPP)。H@CaPP外侧的LMWH能够与炎性内皮细胞和血小板表面的P-选择素结合,其既能发挥抗栓作用抑制循环阶段“肿瘤微栓”的形成,同时也将纳米颗粒靶向至肿瘤原位和“前转移灶”。纳米颗粒内部的PP发挥抗炎作用,通过上调原位肿瘤E-钙粘蛋白和抑制波形蛋白的表达,干预了侵袭阶段的EMT进程;通过抑制细胞间黏附分子-1、血管细胞粘附因子-1、金属基质蛋白酶-9和S100钙结合蛋白A9等蛋白的表达,抑制了“前转移灶”的发展,进而抑制了肿瘤转移的定植阶段(图 1)。作者通过系列实验验证了H@CaPP能够有效干预肿瘤转移的各个阶段,与传统的化疗和手术疗法联用后能明显抑制高侵袭性乳腺癌的转移并显著延长荷瘤小鼠的生存期,且具有良好的安全性。该研究为肿瘤转移的多靶点干预提供新思路,并具有临床转化前景。
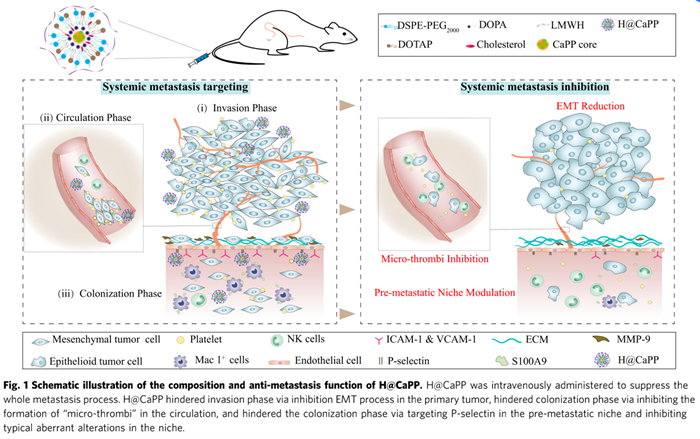
图1. 系统靶向肿瘤转移纳米颗粒的组成及其抗转移效果示意图。图片来源:Nat. Comm.
这篇文章中,复旦大学药学院2019级博士生胥敏俊为第一作者,复旦大学药学院陈钧教授和上海交通大学医学院高小玲研究员为通讯作者。本研究获国家自然科学基金重大研究计划培育项目及国家自然科学基金面上项目的资助。
原文链接:https://www.nature.com/articles/s41467-021-23466-5


