
自噬功能障碍被认为是阿尔茨海默病(AD)的关键病理。最新的研究证据强调,AD背景下存在轴突自噬体逆行运输障碍,严重影响神经细胞对毒性蛋白的自噬降解,并且这一过程足以导致自噬应激和神经元死亡。目前没有针对这一机制的疗法。
复旦大学药学院张奇志教授团队开发了一种“纳米疏浚机”用于共递送siROCK2和多酚紫草酸B (LA)以对抗引起自噬体轴突运输障碍的多重病理。该策略有效逆转了氧化应激、ATP耗竭、自噬阻断和微管破裂,成功疏通了受阻的轴突自噬并提高了自噬流量,从而减少了病理性蛋白积累,改善了AD转基因小鼠的认知功能。研究显示轴突自噬调控是一种有希望的新型AD疗法。
该研究首次发现LA与阳离子聚合物ε-聚赖氨酸(εPLL)、siRNA以及阴离子脂质囊泡(LIP)之间存在氢键、范德华力、疏水等多种相互作用。利用这些特性,研究人员设计了一种新的多酚驱动的纳米粒子组装系统:(1) LA辅助ε-PLL压缩siRNA形成均一纳米复合物(PL-LA/siR),以降低阳离子材料用量及相关毒性;(2) LA促进PL-LA/siR被包裹到LIP中,形成LIP@PL-LA/siR,以增强整体稳定性和生物相容性。与使用游离多酚如EGCG辅助阳离子材料压缩基因形成的三元复合物相比,LIP@PL-LA/siR具有显著进步:(1)改善给药系统的稳定性、安全性,适于多种途径给药;(2) LIP为功能性生物膜融合或官能团修饰提供位点,以利于靶向性发挥;(3) LA/siRNA用药比例可灵活调节,有助于实现针对特定疾病需求的组合治疗。
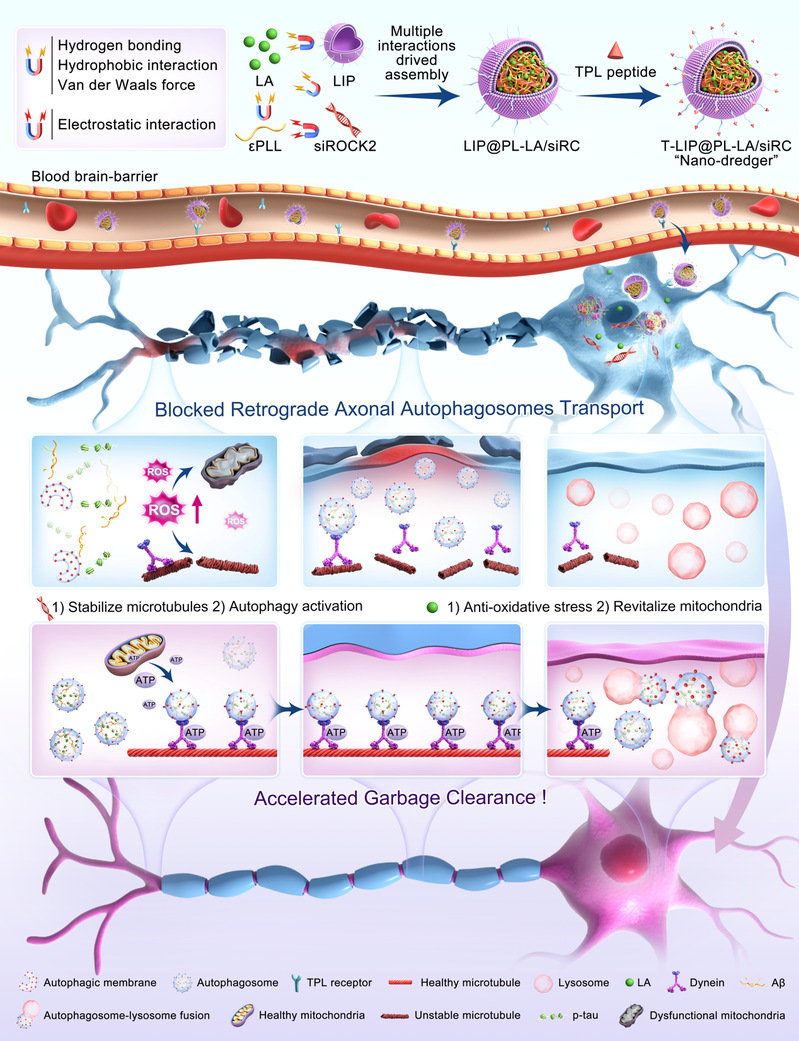
该研究以“Polyphenol Mediated Assembly: Tailored Nano-dredger Unblocks Axonal Autophagosomes Retrograde Transport Traffic Jam for Accelerated Alzheimer's Waste Clearance”为题在线发表于权威期刊Advanced Materials。
复旦大学药学院张奇志教授为本文通讯作者。复旦大学药学院2021级硕士生孟冉为本文第一作者,2022级博士生李羿娴为共同第一作者。该研究获得了国家自然科学基金的资助。
原文链接:https://doi.org/10.1002/adma.202413614


