近日,复旦大学药学院王建新教授课题组在药剂学权威期刊Journal of Controlled Release 2023年第364期上发表了题为Ginsenoside Rg3 endows liposomes with prolonged blood circulation and reduced accelerated blood clearance的研究,并被选为封面论文(图1)。该研究将传统PEG化脂质体中的胆固醇和PEG替换为人参皂苷Rg3,制得的人参皂苷Rg3脂质体具有良好的长循环功能,通过解析其表面吸附蛋白冠成分,阐释了其长循环机制。此外,开展了重复注射后的药代动力学与免疫原性研究,发现与传统的PEG化长循环脂质体相比,Rg3脂质体在重复注射后不会触发类似的加速血清清除现象,在重复注射时具有更好的长循环性能。研究结果为基于人参皂苷的脂质体开发提供了支撑。

图1. JCR杂志封面
聚乙二醇(Polyethylene glycol, PEG)化脂质体(Chol-PEG-lipo)因其体内长循环作用而被广泛用作药物载体,其中PEG化可赋予脂质体长循环功能。然而,PEG化脂质体在重复注射时可能会失去其长循环能力,这被称为“加速血清清除(accelerated blood clearance, ABC)”现象。这是由于PEG具有较强的免疫原性,其重复的O-CH2-CH2亚单位是典型的2类胸腺非依赖性抗原(class-2 thymus-independent antigen, TI-2),可诱导B细胞分泌中和抗体anti-PEG IgM。该抗体将与随后剂量的PEG化脂质体结合并激活补体系统,导致脂质体快速代谢(图2),该现象限制了PEG化脂质体的有效性和安全性,影响了其临床应用。
该研究发现将PEG和胆固醇替换为人参皂苷Rg3后,制备得到的人参皂苷Rg3脂质体(Rg3-lipo)具有与Chol-PEG-lipo相当的长循环作用,且体内循环时间均显著长于传统非PEG化脂质体Cho-lipo。分别对Chol-PEG-lipo和Rg3-lipo重复给药后发现,Chol-PEG-lipo首次注射后血液中浆细胞及其分泌的anti-PEG IgM水平显著增加,第二剂量的Chol-PEG-lipo的循环时间与第一剂量相比显著缩短,且伴随着在肝脏中的大量积累。而Rg3-lipo首次给药后,在血液循环中未观察到明显的浆细胞的活化、IgM分泌和补体激活,第二次注射后体内循环时间没有显著改变。因此,Rg3脂质体在表现出与PEG化脂质体相当的长循环效果的同时,可以有效避免PEG化脂质体诱发的ABC效应。
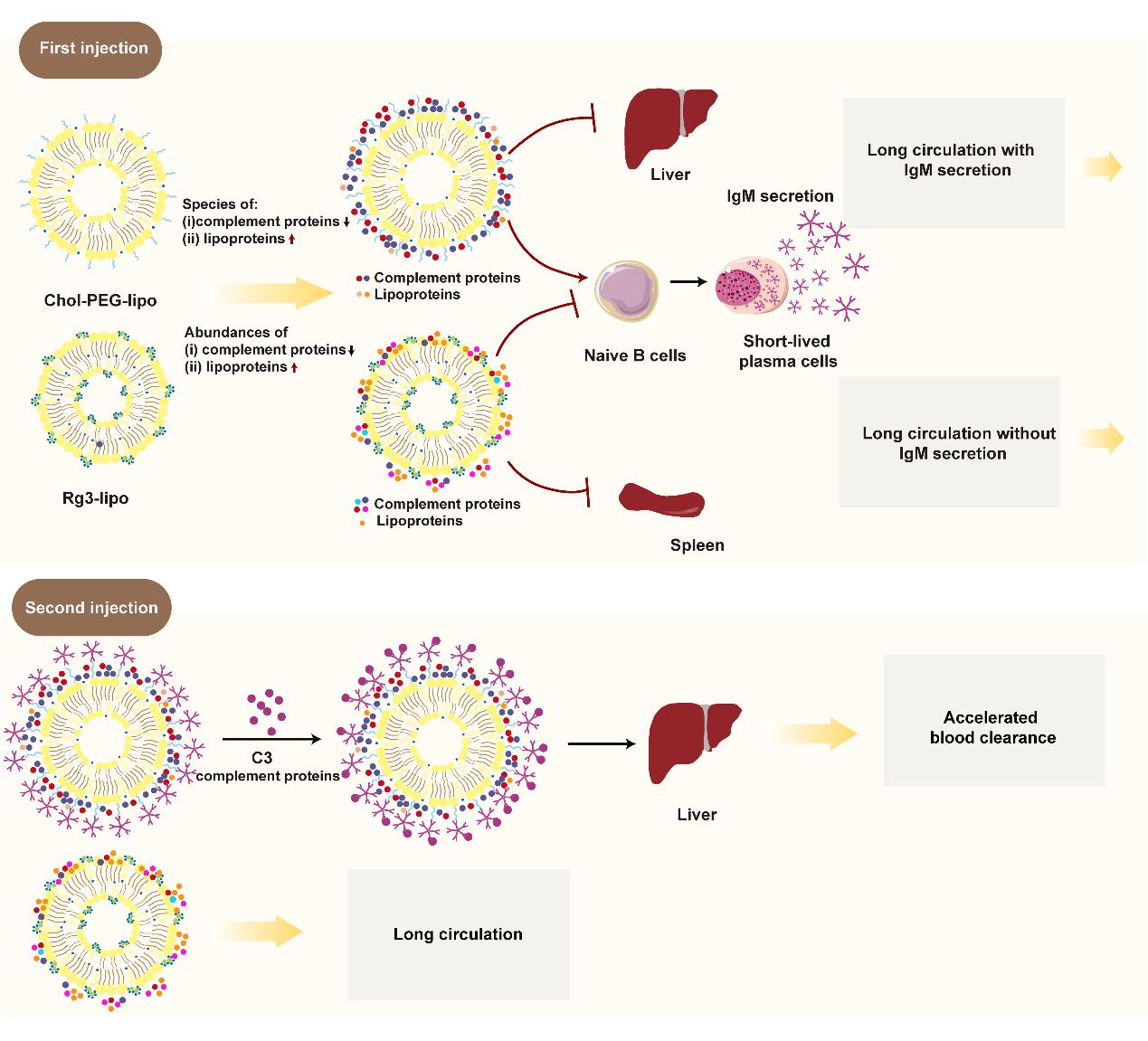
图2. Rg3-lipo和Cho-PEG-lipo重复注射的体内过程示意图
对不同脂质体表面吸附的蛋白冠成分进行分析发现,Rg3-lipo和Cho-PEG-lipo的长循环机制存在差异。Cho-PEG-lipo主要通过减少脂质体表面吸附的调理素蛋白如补体蛋白的种类,及增加吸附的反调理素蛋白如载脂蛋白的种类来延长循环时间。而Rg3-lipo主要通过减少脂质体表面吸附的关键补体蛋白的丰度和增加表面吸附的载脂蛋白的含量来实现长循环(图3)。
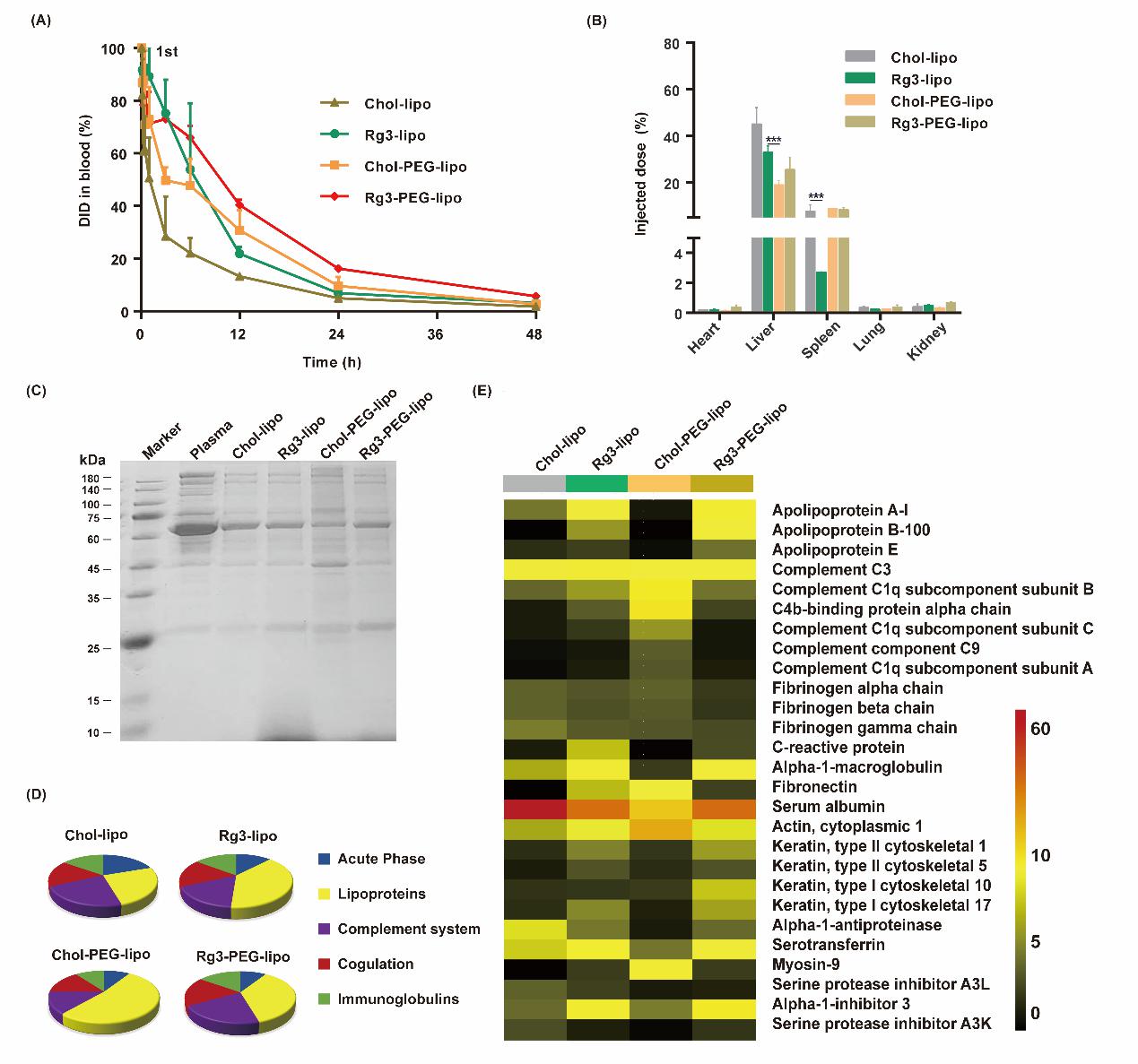
图3. Rg3-lipo和Cho-PEG-lipo的长循环机制
给予第二剂量时,Rg3-lipo的长循环效果与第一剂量时一致。而Cho-PEG-lipo在第二剂量下的半衰期和药时曲线下面积(AUC)要显著低于第一剂量,与传统非长循环脂质体Cho-lipo相比无显著性差异。此外,第二次注射后,Cho-PEG-lipo会在肝脏大量聚集,显著高于第一次注射时Cho-PEG-lipo在肝脏部位的聚集量。而Rg3-lipo前后两次注射后在肝脏和脾脏部位的聚集量均无显著性差异(图4)。由此可知,与Cho-PEG-lipo显著的ABC效应不同,Rg3-lipo在重复注射后仍显示出可持续的长循环效应。

图4. Rg3-lipo和Cho-PEG-lipo在第一剂量和第二剂量下的药代动力学
为阐明Rg3-lipo免于ABC效应的机制,该论文进一步对Rg3-lipo的免疫原性进行了研究。发现Cho-PEG-lipo注射后会诱发B细胞快速活化成为浆细胞进而分泌出大量的anti-PEG IgM,进而介导机体识别后续注射的Cho-PEG-lipo及其快速清除。而Rg3作为小分子,免疫原性低,制备为脂质体注射后并不会诱导B细胞活化以及anti-Rg3 IgM的分泌,因此不会诱导机体对于后续注射的Rg3-lipo的识别与清除(图5)。

图5. Rg3-lipo和Cho-PEG-lip的免疫原性
结合该课题组前期研究结果(Science Advances 2022, Journal of Controlled Release 2021, Nano-Micro Letters 2020等),证明基于人参皂苷Rg3的脂质体具有低免疫原性、可稳定脂质膜结构、肿瘤主动靶向、制备简单等许多优势,具有良好的临床转化前景,同时可作为化疗药物的递送载体发挥协同作用,为肿瘤的有效治疗提供了新的思路。
复旦大学药学院博士研究生夏加璇、硕士研究生陈晨为论文共同第一作者,上海徐汇中心医院徐新春主任医师、复旦大学药学院王建新教授为论文共同通讯作者。该项目得到了国家自然科学基金项目的资助。
论文链接: https://doi.org/10.1016/j.jconrel.2023.10.023


