胶质瘤是最常见的颅内原发恶性肿瘤,约占所有恶性脑肿瘤的80%,具有复发率高、死亡率高和治愈率低等特点。手术是胶质瘤治疗首选方案。但由于胶质瘤脑内浸润性生长特性,外科医生往往难以在术中准确界定胶质瘤边界并引导切除,导致胶质瘤术后高复发率。目前临床使用的磁共振和术中荧光等胶质瘤定位技术主要基于肿瘤导致血管结构破坏,其勾勒的是血脑屏障破坏的区域,而不与胶质瘤浸润区域完全重叠。由于胶质瘤边缘癌细胞密度不断降低,削弱了癌细胞靶向成像技术的特异性和灵敏度,导致胶质瘤浸润区域准确定位面临挑战。因此,发展术中辨别胶质瘤浸润区域新策略对于改善手术预后具有重要意义。近日,复旦大学药学院李聪教授课题组提出可视化免疫抑制巨噬细胞定位胶质瘤浸润边界新策略,相关工作以“Intra-operative Definition of Glioma Infiltrative Margins by Visualizing Immunosuppressive Tumor Associated Macrophages”为题在线发表于《先进科学》(Advanced Science)杂志。
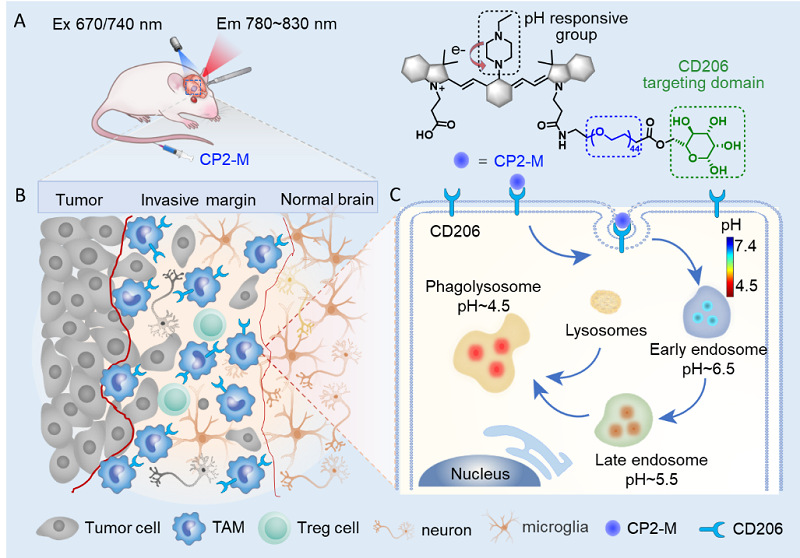
可视化免疫抑制肿瘤相关巨噬细胞定位脑胶质瘤边界。探针CP2-M通过分层靶向策略首先靶向免疫抑制巨噬细胞过度表达的CD206受体,探针经CD206受体介导内吞后在细胞吞噬小体酸性微环境中被激活,实现免疫抑制巨噬细胞的准确定位。
团队通过分析胶质瘤数据库和患者肿瘤标本,发现胶质瘤中M2-TAMs含量明显高于正常组织,免疫组化染色揭示了M2-TAMs在胶质瘤浸润边缘的聚集,据此提出M2-TAMs作为定位胶质瘤浸润边界新靶标的科学假设。该策略通过可视化M2-TAMs而不是癌细胞来界定胶质瘤侵袭边缘,因此不会受到肿瘤边缘癌细胞密度不断降低的影响。为实现M2-TAMs的活体精准定位,本研究提出了分层靶向策略。pH比率响应荧光探针CP2-M首先靶向免疫抑制巨噬细胞特征CD206受体,经CD206受体介导内吞后,探针在巨噬细胞吞噬小体酸性微环境中被激活,实现免疫抑制巨噬细胞的准确定位。基于大鼠和裸鼠胶质瘤模型活体成像研究均表明,CP2-M 能够特异性靶向脑胶质瘤,并高信噪比定位颅内胶质瘤浸润。此外,CP2-M在延长术后存活率方面优于临床常用的胶质瘤导航探针5-ALA和吲哚花青绿(ICG)。行为学实验结果显示,模型鼠在CP2-M导航手术后未造成明显的神经功能损伤。上述研究表明免疫抑制巨噬细胞靶向导航策略为克服胶质瘤边界癌细胞密度降低造成的导航失真,提高胶质瘤手术切除率,降低术后复发率,延长患者生存期提供新路径。
复旦大学药学院博士生曹崇、尹航,华山医院神经外科主治医师岳琪、华山医院博士生杨标是该论文的共同第一作者。复旦大学附属华山医院毛颖教授,复旦大学类脑智能科技研究院张孝勇研究员,复旦大学药学院朱校青年研究员、雷祖海青年研究员、李聪教授为该论文通讯作者。该研究同时得到复旦大学信息学院余锦华教授的支持。该研究工作获得国家自然科学基金、上海市科委生物医药领域科技支撑项目等资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202304020


