近日,复旦大学药学院余科教授团队在期刊Oncogene上在线发表题为“Tissue factor promotes TREX1 protein stability to evade cGAS-STING innate immune response in pancreatic ductal adenocarcinoma”的研究论文,首次揭示在胰腺导管癌(PDAC)中TF通过稳定TREX1蛋白导致逃避cGAS-STING免疫反应的机制,提出TF抑制疗法在PDAC治疗中的潜在应用。

研究通过分析患者基因组学和组织芯片建立了TF与cGAS-STING的关系。TF过表达的患者STING信号激活标志物P-STING/P-TBK1水平极低,干扰素诱导基因(ISGs)和免疫效应细胞的数量减少。此外,通过构建小鼠和人源胰腺原位肿瘤模型,给予敲除TF或者TF抗体(HuSC1-39)治疗,抗肿瘤效果显著并极大地促进了肿瘤内部STING信号激活。
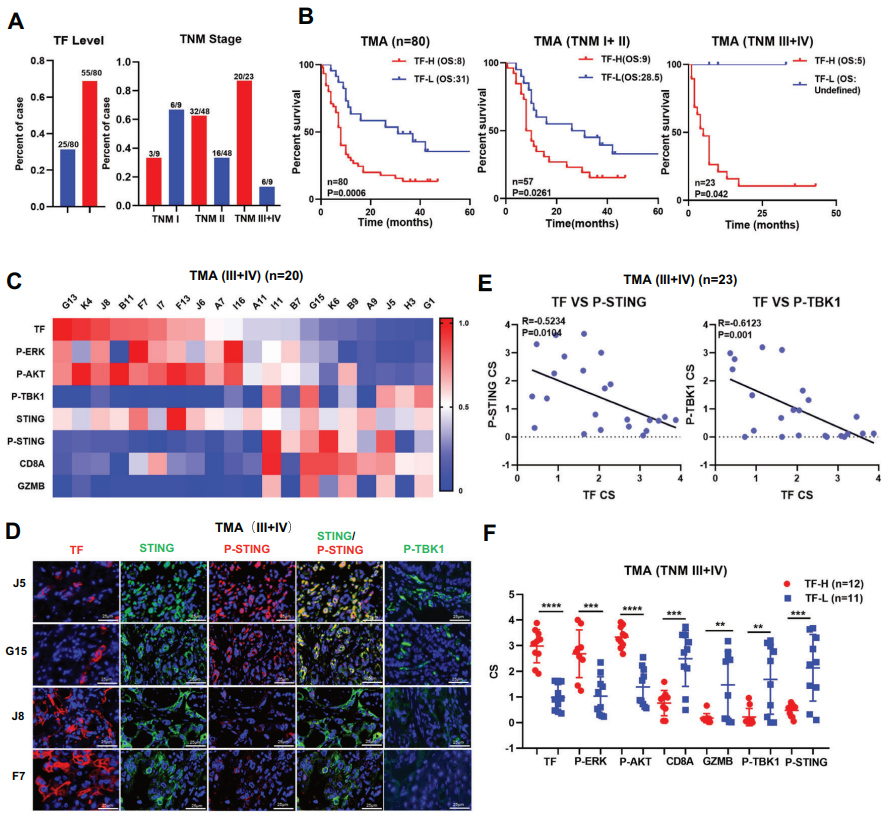
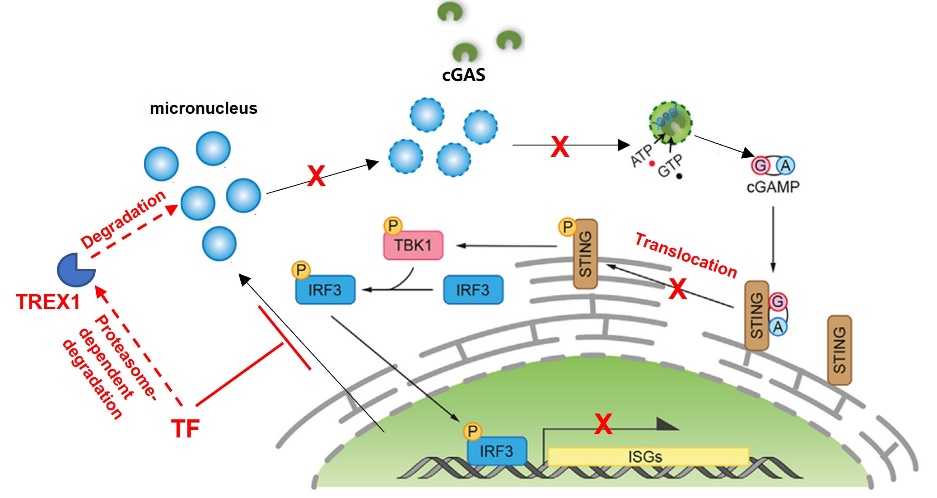
细胞质DNA微核蓄积是触发cGAS-STING先天免疫反应的经典机制,但人们对该调控机制如何在肿瘤中被失效的原因了解甚少。本研究显示PDAC中的TF异常表达能显著降低微核积累,导致cGAS-STING传感链失活。靶向抑制TF后cGAS捕获的胞质微核显著增加,STING信号通路下游CCL5/CXCL10表达显著提高。
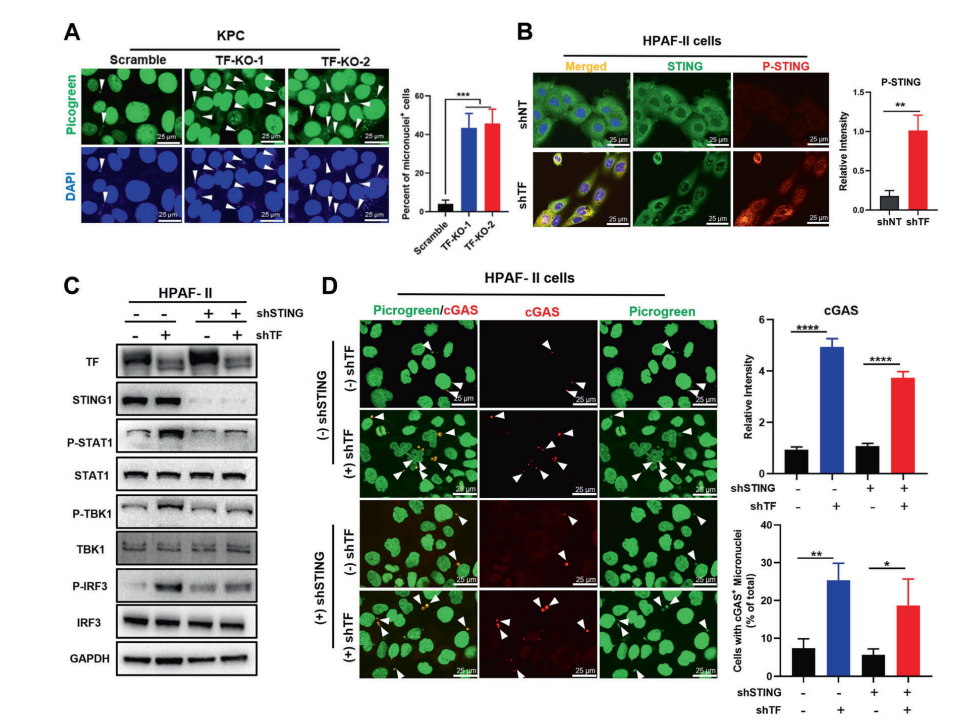
TREX1是一种核酸外切酶,近期被证明可以抑制肿瘤环境中的先天免疫反应。本研究发现给予TF抑制治疗后可迅速触发TREX1的蛋白降解,从而恢复微核蓄积和STING/TBK1级联的磷酸化及功能活性。本研究明确了TF是PDAC中重要的免疫逃逸调节因子;TF抑制剂治疗将提供一种创新疗法,能促进抗肿瘤免疫微环境重塑和治疗效果。
复旦大学药学院2019级博士生薛茵茵为本文的第一作者,复旦大学药学院余科教授为本文的通讯作者。该研究获得国家自然科学基金、国家科技支撑计划重大项目、科技成果转化等基金的资助。
原文链接:https://www.nature.com/articles/s41388-024-03248-1


