超过30%的癫痫患者表现出耐药性,被称为难治性癫痫。手术切除或消融病灶是实现治愈的有效途径,而精准界定致痫灶则是手术成功的核心前提。然而,由于致痫灶边界存在显著的异质性,精准定位一直是神经外科面临的关键技术瓶颈。现有定位技术中,术中皮层脑电图易受麻醉干扰且空间分辨率较低;MRI/PET等影像技术主要提供术前结构成像,难以实现术中快速导航;而现有探针普遍面临灵敏度低、特异性不足及入脑量不足等问题。
针对上述挑战,药学院王聪团队提出了一种基于级联放大比率荧光成像策略,通过协同监测癫痫灶异常放电相关“酸中毒波动”和“神经炎症”两大致痫灶核心病理特征,提出时间累积驱动的信号放大及脑电“解耦型”精准识别,实现了致痫灶长时程、高信噪比显像(图1)。相关成果以题为《级联放大比率荧光探针用于癫痫时间锁定成像》(Cascade-Amplified Ratiometric Fluorescent Probe for Time-Locked Imaging Epilepsy)的研究性文章发表于Advanced Materials杂志。在四种不同的癫痫模型(小鼠/大鼠)中,该探针均展现了稳定的病灶界定能力。相较于临床“金标准”脑电极技术,该探针对致痫灶的对比度平均提升了25%,空间分辨率提升逾10倍,并使残留阳性切缘减少了40.9%,在深部及皮层病灶中均表现良好。该技术引导的手术使总癫痫负荷降低超过67%。
总之,本工作提出一种逻辑驱动型比率荧光信号放大机制,开发了一种具备生物降解性、高跨血脑屏障能力的聚合荧光探针CAR-FM,其核心优势包括:(1)高灵敏度:CAR-FM以“类晶体管”方式响应微弱pH波动(响应阈值< 0.2 pH单位),荧光比率信号呈“乘法式”级联放大,倍数超过150倍;(2)长时程成像:突破了现有技术对术中瞬时电信号的依赖,实现了长达100小时的高信噪比显像(SNR > 3),为术中切除提供了稳定、长效的实时导航;(3)定量便捷采集:采用单激发-双发射的比率成像模式,单次激发即可实现精准定量分析,规避了复杂环境干扰。本工作为癫痫神经外科手术提供了全新策略,有望提升耐药性癫痫患者的手术成功率。其集成式的化学设计不仅提升了癫痫灶定位的精度,更为利用分子协同性开发下一代精准神经诊疗方案提供了概念框架。
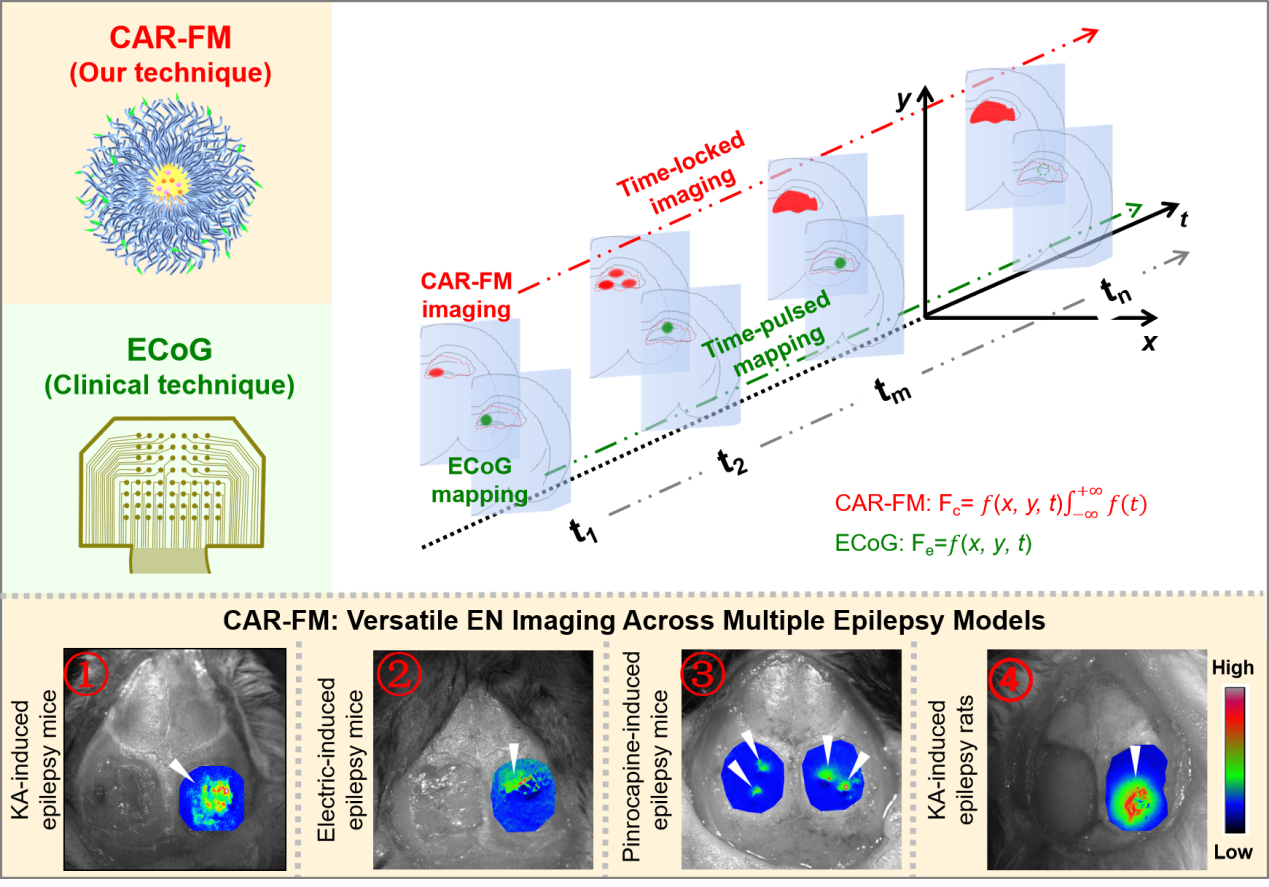
图1.级联放大比率荧光探针用于癫痫成像。
复旦大学药学院博士生王鑫、黎博涵、李敏、陈运灿和类脑智能科学与技术研究院硕士生汤语睿为该论文的共同第一作者。复旦大学药学院王聪青年研究员、朱校青年研究员、李聪教授,中国科学院上海药物研究所程震教授和复旦大学附属中山医院李晓宇教授为论文的通讯作者。该工作获得国家重点研发计划,国家自然科学基金会,上海市启明星项目,复旦大学医工结合项目和克服递药屏障高端制剂全国重点实验室开放课题等项目的支持。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202514336


