光动力疗法(photodynamic therapy, PDT) 是利用光敏剂在特定波长光照射下激活(发生光敏效应)产生单线态氧、自由基及局部或全身免疫反应达到治疗效果的治疗方法。PDT因其高光毒性、低暗毒性、高时空选择性、创伤小、无耐药性等优点,已成为一种有前景的肿瘤和感染性疾病的治疗方法。
复旦大学药学院赵伟利研究员、董肖椿副教授课题组的研究方向之一是新型高效光敏剂的发现及其抗肿瘤、抗感染光动力治疗研究,先后于2020至2022年间在药物化学领域权威期刊《Journal of Medicinal Chemistry》上分别发表了两篇有关Aza-BODIPY抗肿瘤光敏剂研究的论文(J. Med. Chem. 2020, 63, 9950−9964; J. Med. Chem. 2022, 65, 3616−3631)和一篇有关BODIPY抗菌光敏剂研究的论文(J. Med. Chem. 2021, 64, 18143-18157)。
近日,研究团队在《Journal of Medicinal Chemistry》上发表了题为“Discovery of Subcellular-Targeted Aza-BODIPY Photosensitizers for Efficient Photodynamic Antitumor Therapy”的研究论文,报道了一种靶向细胞器的新型Aza-BODIPY近红外光敏剂用于肿瘤的高效光动力治疗。
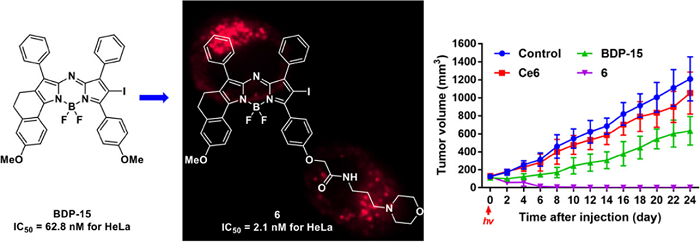
光敏剂在细胞内的不同位置起效会导致不同类型的免疫原性细胞死亡,靶向细胞器的光敏剂可能减少光敏剂剂量并提高光动力治疗效果。本研究通过1, 2, 3-三氮唑或酰胺键将三苯基膦、五氟苯基和吗啉等不同细胞器靶向结构引入课题组前期报道的高效单碘Aza-BODIPY光敏剂(BDP-15)中,以期赋予光敏剂潜在的靶向细胞器能力。所合成的新光敏剂具有强烈的近红外吸收、强光敏化效率、良好的稳定性和小动物水平可视化。体外细胞实验表明线粒体靶向光敏剂和溶酶体靶向光敏剂比内质网靶向光敏剂具有更好的光动力抗肿瘤作用。进一步研究发现,通过酰胺连接吗啉结构的溶酶体靶向Aza BODIPY光敏剂6对于多种肿瘤细胞具有高光/暗毒性比和良好的细胞内溶酶体定位能力。光敏剂6具有高效的细胞内ROS产生能力导致早/晚期细胞凋亡和坏死以杀伤肿瘤细胞。此外,动物实验研究发现,在低光剂量和单次照射条件下,光敏剂6能显著抑制肿瘤生长,并显示出比先导化合物和Ce6更优的PDT作用。本研究成果为近红外抗肿瘤光敏剂的研发提供了新思路,也为后续开发光动力治疗药物提供新的研究基础。
复旦大学药学院药物化学系2017级博士生刘唱为本文的第一作者,药物化学系董肖椿副教授为本文的通讯作者。相关研究工作得到了上海市科委项目、国家自然科学基金等的资助。
原文链接:https://doi.org/10.1021/acs.jmedchem.2c01653


