心血管疾病(CVD)是目前全球死亡率最高的疾病,动脉粥样硬化(Atherosclerosis, AS)是其发病和死亡的主要病因。近几十年来,动脉粥样硬化及其并发症的发病率大幅度上升。在AS发生发展过程中,巨噬细胞介导的炎症反应发挥重要的作用:血液中低密度脂蛋白通过内皮细胞内化并进入动脉壁内膜,导致内皮损伤,从而释放促炎因子并募集单核巨噬细胞;激活的巨噬细胞通过清道夫样受体CD36摄取被修饰的 LDL 等复合物形成泡沫样细胞,经脂质沉淀形成粥样斑块;在AS后期,巨噬细胞分泌的炎性因子加速细胞凋亡和基质降解,从而导致斑块破裂和血栓形成。虽然巨噬细胞在AS和其血栓并发症发生过程中扮演着重要作用,抗炎型巨噬细胞向促炎型的转化是导致动脉粥样硬化血管病变加重、病程延续的关键环节。但巨噬细胞的激活机制至今仍然没有被完全阐明。
2020年7月31日,心血管顶级杂志Circulation Research发表了复旦大学药学院沈晓燕课题组与上海药物所郑明月研究员、上海长征医院曲乐丰教授合作研究成果:Sorting Nexin 10 Mediates Metabolic Reprogramming of Macrophages in Atherosclerosis Through the Lyn-dependent TFEB Signaling Pathway. Circulation Research. 2020;127:534–549。
研究发现,分选连接蛋白10(SNX10)作为溶酶体/内体途径的重要调节蛋白,在人AS斑块中高表达,髓系特异性敲除SNX10可减少高脂饲料喂养的ApoE小鼠的斑块形成并增加斑块稳定性,而且斑块中浸润的巨噬细胞数目显著性下调,呈现抗炎表型为主。进一步研究发现,低密度脂蛋白(LDL)刺激主要通过SNX10招募并活化Lyn-AKT复合体,促进CD36的内化,增加LDL的摄取。而SNX10缺失限制了该复合物的形成,通过抑制CD36的内化减少泡沫细胞形成。同时,SNX10缺失引起的AKT活性下调诱导核转录因子TFEB转位入核。活化的TFEB进一步促进溶酶体生物合成,并增强溶酶体酸性脂肪酶(LAL)的活性,上调线粒体氧化磷酸化水平,通过IRF4途径诱导巨噬细胞向抗炎型表型极化,从而改善AS病理进程(图1)。
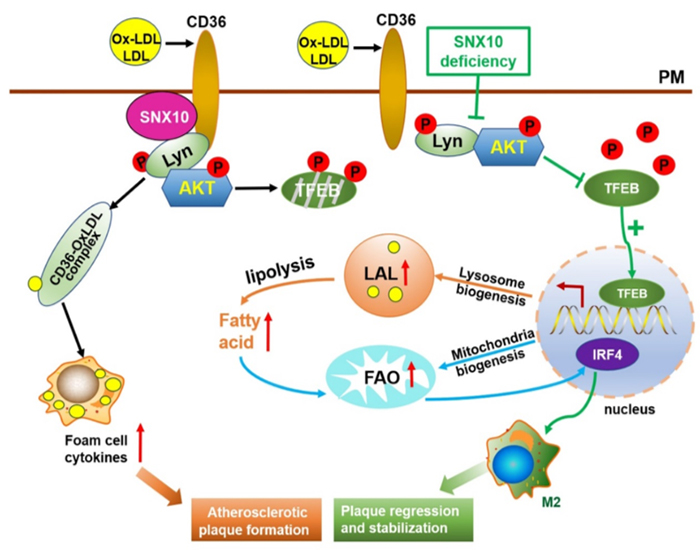
图1.SNX10在动脉粥样硬化形成中的作用示意图
该项工作不仅阐明了SNX10在巨噬细胞代谢重编程中的重要调节作用以及对AS发生、发展的影响,也为SNX10 作为防治动脉粥样性血管疾病的潜在新靶标提供的实验依据。
美国国立卫生研究院博士后游艳(复旦大学博士),复旦大学博士鲍威廉,为共同第一作者,复旦大学药学院沈晓燕教授,上海药物所郑明月研究员与上海长征医院曲乐丰教授为通讯作者。


