近期,复旦大学药学院陆伟课题组利用“搭便车”的方法设计了一种新型诊疗一体化制剂,发展了术中荧光影像引导的光动力联合免疫检查点阻断治疗癌症的新治疗方法,相关成果以“High affinity of Chlorin e6 to immunoglobulin G for intraoperative fluorescence image-guided cancer photodynamic and checkpoint blockade therapy”为题,在线发表于国际知名学术期刊《ACS Nano》(IF 13.903)。
癌症的免疫治疗是继手术、放疗、化疗后的新兴疗法。近年来,免疫检查点阻断治疗取得了显著的临床治疗效果,为癌症的治愈带来新希望。然而,单一使用免疫检查点阻断治疗的病人总体响应率仅为20-30%。
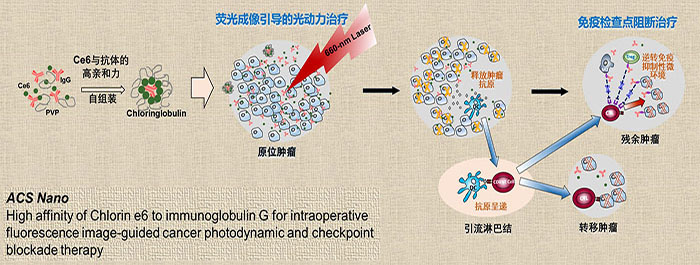
光动力疗法是一种联合无毒性/低毒性的光敏剂及相应的光源,通过光动力学反应产生活性氧簇,破坏肿瘤组织的治疗技术。由于进入组织的光敏剂只有达到一定浓度并受到足量光照射,才会引发光动力学反应而杀伤靶细胞,因此它是一种高特异性、安全的癌症局部治疗方法。对于无法通过手术彻底切除的残余微小肿瘤实施光动力治疗,可有效降低癌症的复发和转移。更为重要的是,光动力治疗在杀死肿瘤细胞的同时,使肿瘤细胞释放肿瘤抗原,诱导宿主产生免疫反应。近期的动物实验研究表明,光动力联合免疫检查点阻断治疗肿瘤可产生协同的疗效。
对于残余微小肿瘤的光动力治疗,需要借助术中影像进行检测,方能实施精准光照治疗。目前的研究方法通常将光敏剂包载于纳米载体中,利用纳米粒子在血中循环时间长的特性,增加光敏剂在肿瘤中富集。利用光敏剂自身的荧光性质实现术中荧光成像引导的光动力治疗。然而,光敏剂分子需要在光动力治疗后迅速从体内清除,以减少光毒性带来的副作用。这样的设计使得光敏剂分子跟随纳米粒子在血中的滞留时间大大延长,增加了光毒性。
团队研究人员偶然发现免疫球蛋白G(就是通常说的抗体)与一种叫作二氢卟吩的光敏剂分子存在天然的高亲和力,利用该分子间的亲和作用,将光敏剂分子以“搭便车”的形式,由大分子抗体携带进入肿瘤,在增加肿瘤内富集的同时并不延长光敏剂在血中的清除速率。这种制备方法可以将任意一种或多种免疫检查点阻断抗体与光敏剂进行组合,实现术中荧光影像指导的光动力联合免疫检查点阻断治疗的新疗法。
研究人员制备了抗PD-L1抗体与光敏剂的组合制剂,在荧光影像指导下实现了对小鼠原位胶质瘤手术切除,提高了肿瘤切除的精准度,并联合术后光动力治疗以及PD-L1免疫检查点阻断治疗,进一步提高了对胶质瘤的治疗效果。通过制备得到抗PD-L1抗体、抗CTLA-4抗体两种抗体与光敏剂的组合制剂,实现了对≤1 mm的小鼠原位结肠癌的术中荧光成像指导光动力治疗联合PD-L1与CTLA-4双重免疫检查点阻断治疗,显著延长小鼠的生存时间,并产生长期的免疫记忆效应,有效的抑制肿瘤复发。本研究为术中荧光影像引导的光动力联合免疫检查点阻断治疗癌症提供了诊疗一体化制剂设计的新思路,具有临床转化价值。
复旦大学药学院许娇娇和余胜为该论文的共同第一作者。复旦大学药学院陆伟教授和上海交通大学医学院肖泽宇教授为共同通讯作者。复旦大学药学院付伟教授和曹忠莲老师分别对于分子模拟对接和蛋白结合实验做出悉心指导。该研究获得国家自然科学基金项目和上海市优秀学术带头人计划资助。
全文链接:https://pubs.acs.org/doi/10.1021/acsnano.9b03466


