近期,复旦大学药学院蒋晨教授课题组开发了一种新型的载药四氧化三铁纳米粒,并进行了抗肿瘤免疫治疗及肿瘤微环境响应MRI成像考察相关研究。近日,相关成果以《肿瘤微环境响应聚集的载药磁性纳米粒实现有效的免疫原性抗肿瘤化疗》“Tumor Microenvironment-Triggered Aggregated Magnetic Nanoparticles for Reinforced Image-Guided Immunogenic Chemotherapy”为题,在线发表于《先进科学》(Advanced Science)。
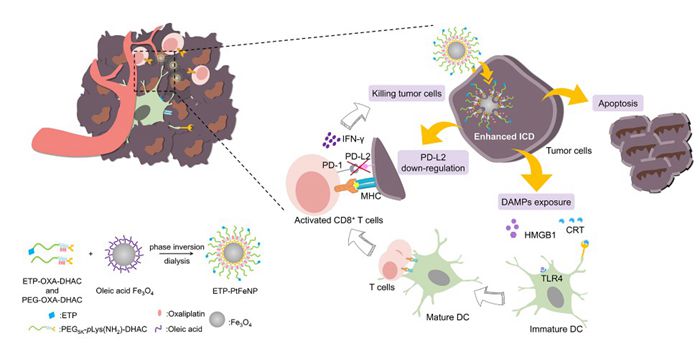
目前,基于免疫检查点抑制剂等的抗肿瘤免疫治疗策略已在临床上取得了较大的成功。然而,其存在的问题也十分棘手:肿瘤响应性低,且极易诱导免疫相关不良反应(irAEs)。因此,亟需设计和开发有效的治疗策略来改善抗肿瘤免疫治疗存在的不足。
奥沙利铂等传统化疗药物,在进行抗肿瘤治疗时,除了发挥其细胞毒性外,还可以诱导肿瘤细胞释放不同与肿瘤抗原的免疫刺激分子(CRT,HMGB1,HSP70/90,ATP),该过程被称为免疫原性死亡(ICD)。这些刺激分子可促进抗原呈递细胞的成熟以及细胞毒性淋巴细胞的募集,上调在肿瘤局部的抗肿瘤免疫应答。该治疗策略有望成为新一类的抗肿瘤免疫治疗方案。针对肿瘤免疫原性死亡诱导的机制研究发现,免疫刺激分子的释放与细胞内氧化应激(ROS)水平及其分布密切关系,有效的内质网应激是“eat me”信号分子-钙网蛋白发生细胞膜转运的关键诱因。虽然,奥沙利铂可以通过激活NOXs酶产生单线态氧,但是,产生的单线态氧易被SODs歧化分解成双氧水,降低了其ROS水平。最近的研究表明,基于芬顿效应的铁死亡策略,可在短时间内诱导产生大量的ROS,且其底物正是双氧水。基于以上,作者设计了一种新型的肿瘤微环境响应聚集的载药四氧化三铁纳米粒。在实现有效肿瘤靶向后,修饰了靶向基团的纳米粒摄取进入肿瘤细胞,在胞内还原性物质(如谷胱甘肽、抗坏血酸钠)的作用下,释放出化疗药物奥沙利铂和铁离子。奥沙利铂与铁离子协同增强胞内ROS水平,诱导细胞发生有效的免疫原性死亡。同时,随着具有屏蔽作用的奥沙利铂的离去,四氧化三铁纳米粒聚集,增强了MRI造影效果,实现对肿瘤的有效诊断。该研究为抗肿瘤免疫治疗提供了新的思路。
复旦大学药学院博士研究生陈钦俊为论文的第一作者,蒋晨教授为论文的共同通讯作者。该研究获得国家自然科学基金、上海市优秀学术带头人计划和复旦-上海药物所融合基金的支持。


