在细胞空间组织的动态调控背景下,液液相分离(Liquid-liquid phase separation, LLPS)展现出构建仿生智能递药系统的潜力,能够实现环境响应性释放与多组分协同递送。然而,针对病理微环境复杂动态特性的LLPS递药系统设计,其指导原则与实现路径尚缺乏系统性梳理。因此,本文基于LLPS在生理调控与疾病发生中的双重角色,结合近年来LLPS智能递药载体的设计进展,尝试总结该领域的现有策略并展望其未来发展方向。相关成果以Liquid-liquid phase separation mediated order and pathological chaos: From cellular organization to precision modulating为题,在线发表于国际知名期刊Journal of Controlled Release。
近年来,随着对生物分子凝聚体功能与调控机制认识的不断深入,其动态可逆的组装特性和精准的微环境响应能力,为药物递送系统的设计带来了新的启示。基于LLPS原理构建的递送体系,能够模拟生命系统的动态自组织行为,通过响应生理或病理信号实现药物的智能化控释,为精准递送策略的开发提供了重要的研究思路与方向。
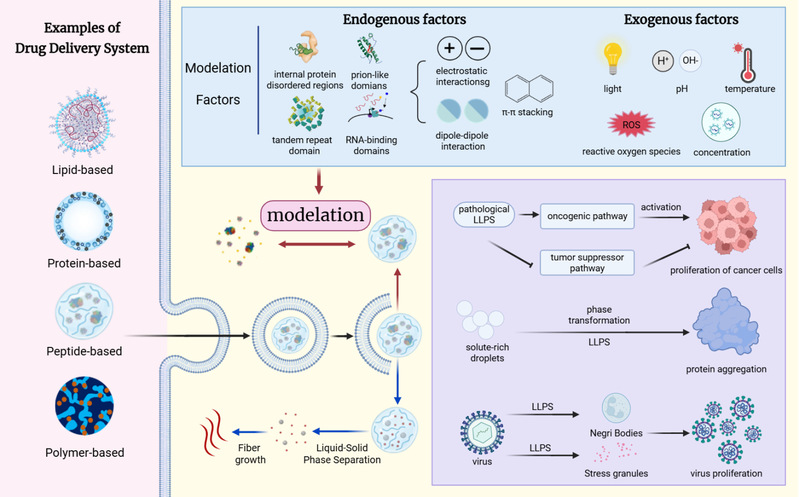
图1 LLPS在生物分子凝聚体形成与智能药物递送中的作用机制示意图
这篇综述系统阐述了LLPS在生命科学基础原理、生理病理作用及药物递送中的前沿进展。文章首先从热力学与动力学视角出发,阐释了LLPS的物理化学本质,指出其通过多价弱相互作用驱动生物大分子形成动态、无膜的生物分子凝聚体,进而在细胞内建立如核仁、应激颗粒等功能性区室结构,并精密调控基因表达、信号传导和细胞骨架重构等关键生命活动。然而,LLPS亦与多种疾病进程密切相关。文章重点分析了LLPS在癌症、神经退行性疾病及微生物感染中的核心病理机制,例如平衡失调引发的异常聚集,以及生理性LLPS过程被异常利用或放大等现象。这些发现共同揭示了LLPS在生理与病理过程中复杂而多元的作用。
基于对LLPS机制的深入理解,文章进一步展望了将其原理创新性应用于药物递送系统的设计前景。LLPS作为一种动态、可逆的相分离过程,能够模拟细胞内无膜细胞器的形成机制,为构建智能型药物载体提供了新的仿生思路。利用脂质、多肽、蛋白质及聚合物等生物相容性材料设计出的多种LLPS递送平台,展现出以下独特优势:首先,LLPS系统能够在靶位点原位形成高浓度药物储库,实现药物的局部富集与长效释放,显著提高药物在病灶区域的滞留时间和治疗效果。其次,由于LLPS过程对环境因素(如pH、温度、离子强度、酶活性等)高度敏感,这些系统具备多重刺激响应释放能力,可实现在特定病理微环境下的精准药物控释。并且LLPS平台支持多种治疗分子的协同装载与递送,包括小分子化学药、核酸类药物(如siRNA、mRNA)以及蛋白质等大分子生物制剂,为联合治疗和多功能协同干预提供了可行载体。尽管LLPS递送系统在稳定性、普遍适用性和生物相容性方面仍面临挑战,例如相分离过程的可控性、体内动态稳定性以及长期安全性有待进一步优化,但其独特的物理化学性质和动态调控能力,为精准药物递送开辟了新的途径。
复旦大学药学院2023级本科生陈朗、庄卓萍、范有翔为本文的共同第一作者,孙涛副教授为论文的通讯作者。该研究工作获得国家重点研发计划、国家自然科学基金等项目支持。
原文链接:https://doi.org/10.1016/j.jconrel.2025.114516


