2024年6月19日,复旦大学药学院药理学系张雪梅教授团队在《Autophagy》杂志发表题为“Activation of BK channels prevents diabetes-induced osteopenia by regulating mitochondrial Ca2+ and SLC25A5/ANT2-PINK1-PRKN-mediated mitophagy”的研究论文。
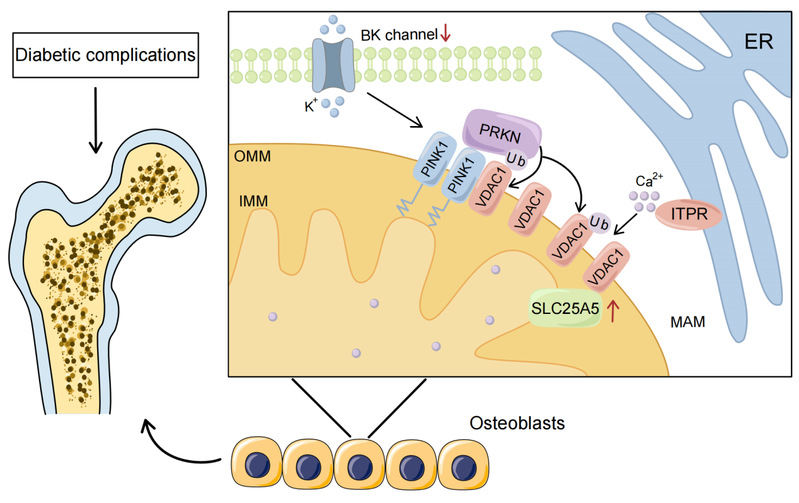
该研究工作发现BK通道能够通过线粒体相关内质网膜(Mitochondria-associated endoplasmic reticulum membrane,MAM)调节线粒体钙浓度,并观察到BK通道能够通过钙离子转运间接调节线粒体内膜蛋白腺苷酸转运体2(Solute carrier family 25 member 5/Adenine nucleotide translocator 2,SLC25A5/ANT2)的表达。同时,本研究详细阐述了BK通道介导PINK1/PRKN线粒体自噬的具体机制。该论文共同第一作者为复旦大学姜岚博士生以及闵行区中心医院贺海东和唐余燕,通讯作者为复旦大学张雪梅教授、复旦大学附属儿科医院李智平教授等。本研究项目受到国家自然科学基金和上海市科技创新项目的大力支持。

糖尿病是由胰岛素分泌不足和/或胰岛素抵抗引起的代谢紊乱,其中I型糖尿病患者常常伴随着骨量丢失和骨密度降低的症状。长期病程促进骨基质中糖基化终末产物(Advanced glycation end products,AGEs)的沉积、微血管的损伤和促炎因子的分泌等病理因素,损害了骨细胞的活性和骨修复的过程,如糖基化终末产物能够促进骨骼微环境中的氧化应激,强化胶原蛋白交联,使骨骼变得僵硬,更容易发生骨折。糖基化终末产物的堆积会增强糖尿病患者的骨脆性,从而增加其骨折的风险,严重影响患者的日常生活。因此,寻找新的调控成骨细胞活力和分化功能的分子靶点是糖尿病骨再生修复的关键科学问题之一。
大电导钙激活钾离子通道(Big-conductance Ca2+-activated K+ channels,BK channels)在多种细胞和细胞器中广泛分布,BK通道的激活能够受到胞内Ca2+浓度和膜电势的双重调控,是耦联细胞电信号和化学信号的重要分子。BK通道由α、β、γ 3种亚基组成,其中α亚基是BK通道的核心,BK通道的α亚基由Kcnma1基因编码,能够行使离子通道的主要功能,负责对K+的传导以及构成电压感受和Ca2+调控的结构域。BK通道在多种生理功能中起到了十分重要的作用,包括调节神经元、细胞分泌、调控平滑肌以及影响细胞增殖和迁移等。
研究人员通过链脲佐菌素(Streptozocin,STZ)构建的I型糖尿病小鼠和大鼠模型,发现糖尿病诱导的损伤骨骼中BK通道的蛋白表达显著降低。由于糖基化终末产物是糖尿病发展过程中重要的致病因子,能够破坏成骨细胞内细胞器的基本功能。研究人员使用糖基化终末产物对小鼠成骨细胞系MC3T3-E1以及小鼠原代骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)进行体外实验造模,以模拟糖尿病微环境对成骨细胞和骨髓间充质干细胞的影响。结果显示,糖基化终末产物能够显著降低MC3T3-E1细胞和BMSC细胞中成骨标志物的表达水平,同时显著减少了BK通道蛋白的表达量。研究人员进一步构建了成骨细胞BK通道条件性敲除小鼠,发现糖尿病会导致条件性敲除小鼠的体重大幅下降,且进一步损伤了小鼠的骨骼质量,提示在病理情况下BK通道对骨骼具有重要的保护作用。同时,研究人员也发现BK通道开放剂能够改善糖尿病小鼠骨骼的质量。
机制上,研究人员发现BK敲除后成骨细胞线粒体内钙离子的水平显著升高,其钙离子的转运机制与MAM有关,可以调控MAM的重要组成电压依赖性阴离子通道蛋白1(Voltage-dependent anion channel 1,VDAC1)K27位的泛素化修饰水平,提示可能与调控线粒体功能密切相关。同时,研究人员发现BK通道的过表达能够抑制自噬小体的形成。为了进一步验证BK通道对线粒体自噬的具体调控途径,研究人员发现BK-WT成骨细胞在过氧化氢的刺激下,细胞内PINK1和PRKN的共定位增加,并且BK-KO后PINK1和PRKN的共定位也明显增多。此外,近年发现线粒体内膜蛋白SLC25A5/ANT2是调控PINK1-PRKN所介导的线粒体自噬过程的重要分子,研究人员发现BK通道的过表达可以显著降低SLC25A5/ANT2的表达水平。在MAM钙转运抑制剂的作用下BK通道对PINK1和ANT2的调控作用减弱,提示BK通道通过Ca2+转运调控ANT2-PINK1-PRKN所介导的线粒体自噬。
综上所述,成骨细胞BK通道在糖尿病诱导的骨损伤中发挥作用,BK通道的敲除能够通过MAM诱导线粒体钙超载,而且其能够诱导SLC25A5/ANT2-PINK1-PRKN信号通路介导的线粒体自噬。
原文链接:https://doi.org/10.1080/15548627.2024.2367184
参考文献:Jiang L, He H, Tang Y, et al. Activation of BK channels prevents diabetes-induced osteopenia by regulating mitochondrial Ca2+ and SLC25A5/ANT2-PINK1-PRKN-mediated mitophagy. Autophagy. Published online June 19, 2024. doi:10.1080/15548627.2024.2367184


