微管(Microtubule)是构成细胞骨架的主要成分。由于恶性肿瘤细胞有着快速增殖能力、有丝分裂和微管功能都十分旺盛,使得微管成为最成功的抗肿瘤靶点之一。目前已经发现并上市了许多微管靶向药物,但随着耐药性的迅速发展,这些药物的长期应用导致其临床疗效逐渐减弱甚至失效。Katanin是一种微管剪切蛋白(Microtubule severing protein),可通过水解ATP剪切微管、使微管解聚。因此,同时作用于微管蛋白(Tubulin)和微管剪切蛋白(Katanin)的双靶点化合物可能产生更强的微管动力学扰乱和抗肿瘤作用,这种独特的作用机制有望克服当前微管靶向类药物所面临的耐药性问题。
复旦大学药学院王洋教授课题组近年来报道了多种新型微管聚集抑制剂并系统总结了构效关系规律(J. Med. Chem.2016, 59, 10329; Bioorg. Med. Chem.2017, 25, 6623; Eur. J. Med. Chem.2018, 144, 817; Eur. J. Med. Chem. 2019, 178, 177; Eur. J. Med. Chem. 2020, 197, 112323; Eur. J. Med. Chem.2021, 214, 113256; Eur. J. Med. Chem.2021, 221, 113531; Bioorg. Chem.2021, 115, 105239; Eur. J. Med. Chem.2022, 236, 114344; Bioorg. Chem.2022, 128, 106112; Bioorg. Med. Chem.2023, 92, 117437),其中多个优选化合物具有显著的体内外抗肿瘤活性和良好的安全性。
近日,王洋教授团队在药物化学权威期刊《Journal of Medicinal Chemistry》发表了题为“Discovery of Novel Diaryl-Substituted Fused Heterocycles Targeting Katanin and Tubulin with Potent Antitumor and Anti-multidrug Resistance Efficacy”的研究论文,报道了一系列具有强效抗肿瘤和抗多药耐药作用、靶向Katanin/Tubulin的新型二芳基取代稠杂环类化合物的发现,并阐明了其作用机制。
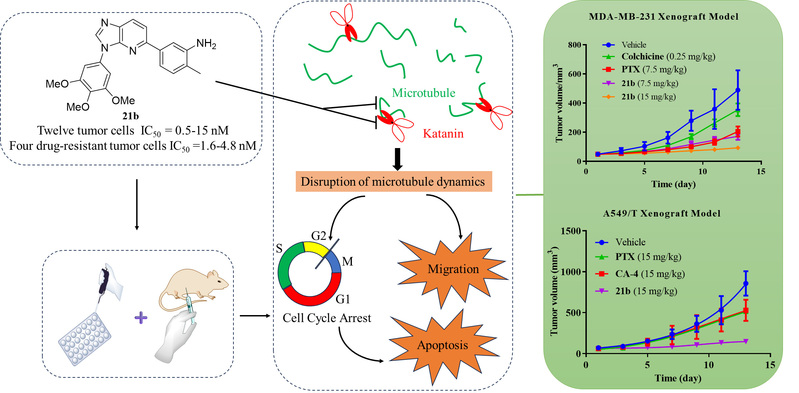
研究团队在前期工作的基础上,通过分区设计、表型筛选和逐步优化,获得了多个具有优秀抗肿瘤活性的化合物,随后通过成药性评价和深入的活性研究,最终发现了以化合物21b为代表的咪唑并[4,5-b]吡啶类新型Katanin/Tubulin双功能剂。作用机制研究表明,优选化合物21b对Katanin和Tubulin具有优异的双重靶向作用,能够破坏肿瘤细胞的微管网络、导致细胞G2/M周期阻滞进而诱导肿瘤细胞凋亡。21b还能够抑制体外集落形成和血管生成,并对12种肿瘤细胞株和4种耐药肿瘤细胞株具有强效的抗增殖作用(IC50 = 0.5-15 nM)。此外,21b还能够抑制肿瘤细胞迁移、下调转移相关蛋白的表达。急性毒性实验结果表明,21b的LD50值为150 mg/kg,具有较好的安全性。在裸鼠乳腺癌移植瘤模型中,21b在7.5和15 mg/kg剂量下显著抑制肿瘤生长并且没有表现出明显的毒副作用。在紫杉醇耐药的肺癌移植瘤模型中,21b克服了临床相关的紫杉醇耐药,展现出良好的安全性和优异的单药体内抗肿瘤效果,具有潜在的开发和应用前景。
复旦大学药学院药物化学系2021级博士生姜富豪和2023级博士生余敏是该论文共同第一作者,王洋教授为论文通讯作者。该研究工作得到了国家自然科学基金委的项目资助。
原文链接:https://doi.org/10.1021/acs.jmedchem.4c00878


