癫痫进展期间,致痫灶除了神经元异常放电和神经胶质细胞炎症反应之外,还存在较为严重的神经元受损及丢失状况,因此需要相关策略对其进行修复。此外,致痫灶受损的血脑屏障也亟待修复,从而尽可能减少外源性物质的渗漏,避免其诱发新的癫痫进展事件。目前已有向脑内转染神经营养因子相关基因,或者直接递送NGF等大分子药物的研究,它们能够挽救濒死的神经元,恢复血脑屏障紧密性,甚至促进突触重塑与神经再生。但遗憾的是,目前尚无有效策略将炎症微环境调控与致痫灶修复相结合,无法对癫痫病灶各种事件进行全面管理。这可能是因为参与到癫痫进展的关键细胞(神经元、小胶质细胞、星形胶质细胞、血管内皮细胞、炎性单核细胞、中性粒细胞)种类太多,相关损伤因素太复杂,难以同时兼顾针对不同细胞的治疗需求。
对于药物递释系统,可充分发挥其易于多功能化设计的优势,使其兼具调控和修复致痫灶功能。芬戈莫德是一种临床上用于治疗多发性硬化的小分子抗炎药物,其主要作用于外周淋巴结内的B细胞、T细胞等获得性免疫细胞,调节其S1P受体。据文献报道,活化的小胶质细胞、星形胶质细胞、炎性单核细胞及粒细胞等固有免疫细胞,也会过表达S1P受体,因此芬戈莫德如果在CNS内给药,有望广泛作用于致痫灶神经免疫相关细胞,从而减轻神经炎症。此外,芬戈莫德还具有抑制mTOR信号通路、抑制P-糖蛋白表达、抗惊厥等多种作用,并且能够在致痫灶保护神经元及血脑屏障完整性。胞磷胆碱钠作为一种小分子神经保护剂,主要在受损细胞内促进磷脂合成,从而重建因脂质过氧化而受损的细胞膜,修复受损细胞。对于致痫灶,胞磷胆碱钠还能恢复钠/钾-ATP酶的活性,增强神经元供能,减轻过量谷氨酸诱发的兴奋毒性;同时其抑制磷脂酶A2活性,减少胞内自由基生成,缓解氧化应激对神经元的损伤。
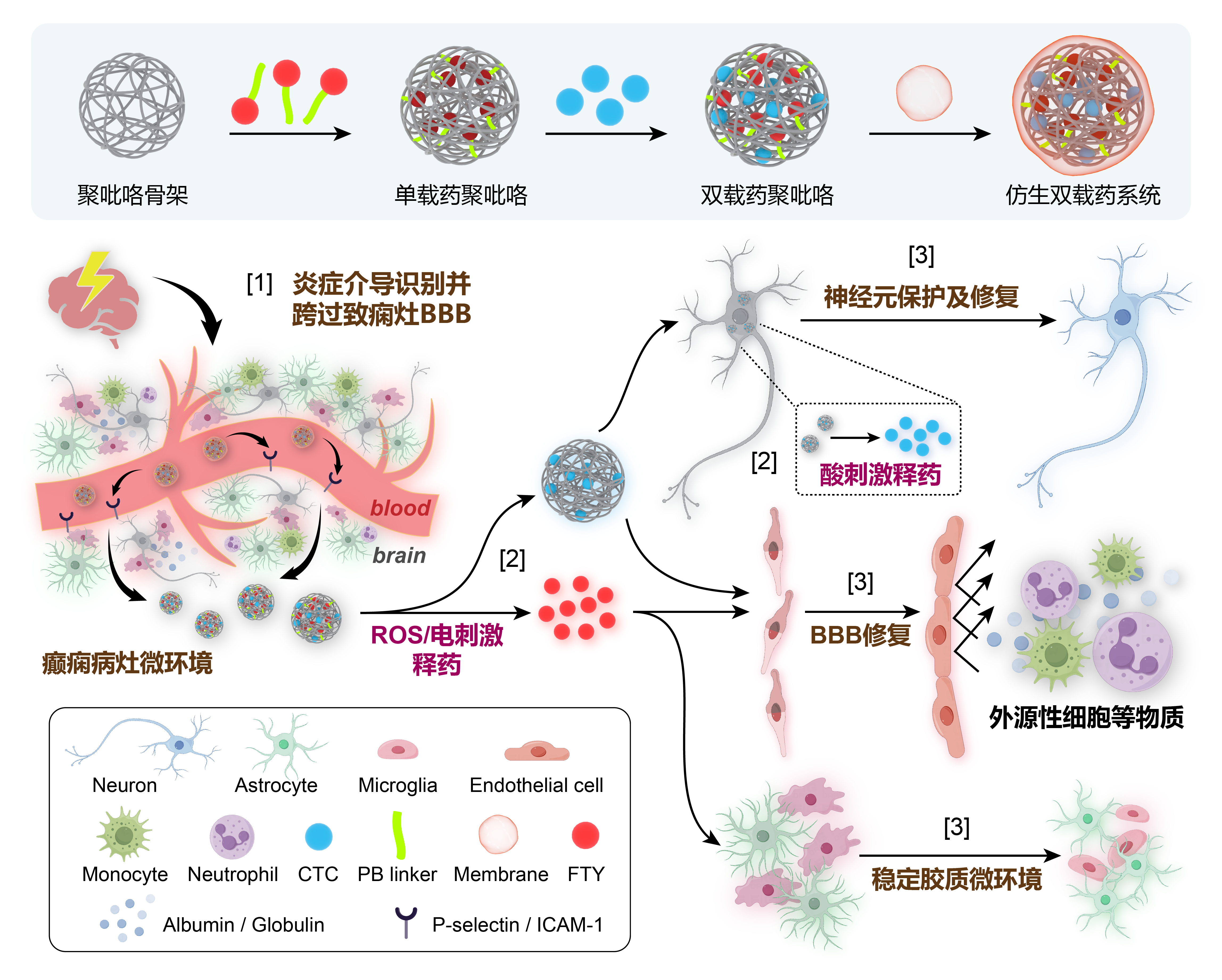
图1巨噬细胞膜仿生双载药聚吡咯系统的设计思路和治疗策略。[1]载药系统被巨噬细胞膜包裹后,能够在体内识别并结合炎症状态下的癫痫病灶血脑屏障,然后跨过血脑屏障进入病灶脑实质;[2]载药系统既能在胞外响应ROS和异常生物电刺激而加速释放芬戈莫德,又能被胞内溶酶体酸性环境刺激而释放胞磷胆碱钠;[3]载药系统一方面释放两种药物,另一方面能够清除病灶ROS,最终发挥保护和修复受损神经元、稳定胶质细胞微环境、恢复血脑屏障完整性的多重疗效。
因此,本研究在调控异常放电和炎症微环境的基础上,进一步思考致痫灶多种损伤因素亟待修复的核心问题。基于上述调控炎症及修复病灶的协同策略,本研究为了同时递送多种药物,选择生物相容性良好的导电材料聚吡咯为骨架,构建双载药系统(图1)。聚吡咯内部的π-π堆叠作用能够增强载药系统稳定性,并且其带电性质有望实现异常生物电刺激响应功能。芬戈莫德的丙二醇结构可与苯硼酸成酯,因此以苯硼酸为连接基团(PB linker),将芬戈莫德共价连接于聚吡咯骨架。苯硼酸基团能够响应高浓度ROS刺激而释放芬戈莫德,实现致痫灶选择性释药,并清除ROS,从而调控微环境的免疫炎症状态。另外,带电聚吡咯骨架能够吸附碱性药物胞磷胆碱钠,并响应酸性环境而释药,从而在致痫灶发挥促进神经修复功能。此外,在载药系统表面包裹仿生巨噬细胞膜,能够在血管内给药时逃避网状内皮系统的吞噬,识别并跨过炎症状态下的血脑屏障,运送载药系统优先到达致痫灶。体内外各项实验结果表明,仿生双载药系统能够选择性识别癫痫病灶并按需释放药物,对多种细胞和病理因素发挥治疗作用,从而协同调控和修复癫痫病灶微环境。该递释系统聚焦于致痫灶多种损伤亟待修复的核心问题,有望为修复受损脑区、阻断并逆转癫痫进展病程的抗癫痫药物疗法提供一种可行方案。
相关研究成果以“Multiple-Stimuli-Responsive Biomimetic Polypyrrole Delivery System for Synergistic Regulation and Restoration of Epileptic Foci”为题,在线发表于Advanced Functional Materials,DOI为10.1002/adfm.202510305。复旦大学药学院2020级博士研究生周政为第一作者,蒋晨教授为通讯作者。详情请参考https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202510305。


