4月23日,复旦大学药学院教授、上海市药物研发协同创新中心主任邵黎明及其智库团队的研究文章“中国药品加快上市注册程序对新药审评审批的影响”(The impact of accelerated drug marketing registration procedures on the review and approval of new drugs in China)在Nature Reviews Drug Discovery期刊上线发表。

自2015年起,我国政府陆续出台相关政策,鼓励药品创新,加快严重及罕见疾病药物的上市。2020年,NMPA修订《药品注册管理办法》,设立了“突破性治疗药物、附条件批准、优先审评审批、特别审批”四个药品加快上市注册程序。
文章通过分析2016-2024年中国药品加快上市注册程序对新药审评审批的影响,显示近9年来中国药品加快上市注册程序(ADMRPs)显著缩短了新药的平均审评时间(加快147天)。中国药品监管体系改革的持续推进已取得积极成效,不仅提升了创新疗法的可及性,也促进了国内外新药的市场准入。
新药获批数量
2016-2024年期间,中国国家药品监督管理局(NMPA)累计批准1100个新药申请,其中化药692个(63%)、生物制品368个(33%)、中药40个(4%)。在1100个新药中,近40%(455个)通过加快上市注册程序(ADMRP)获批。2020-2024年间新药主要通过三种ADMRP途径获批上市:优先审评审批(PRA)276个、附条件批准(CA)121个,突破性治疗药物(BTD)55个。
进口新药获批数量始终高于国产新药,但国产新药增长显著——2024年达106个。通过加快上市注册程序获批的455个药物中,国产新药获批峰值出现在2021年(41个)。
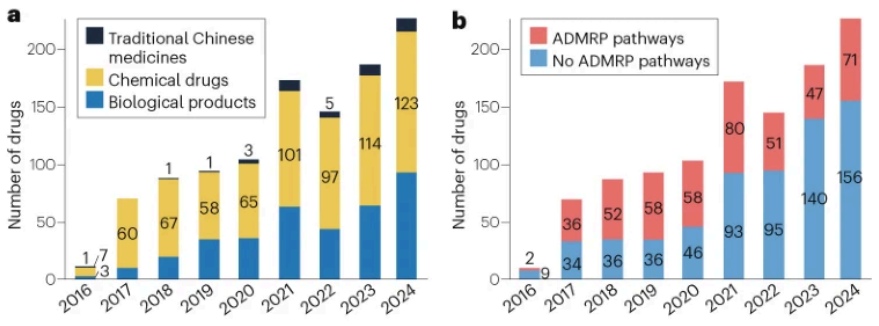
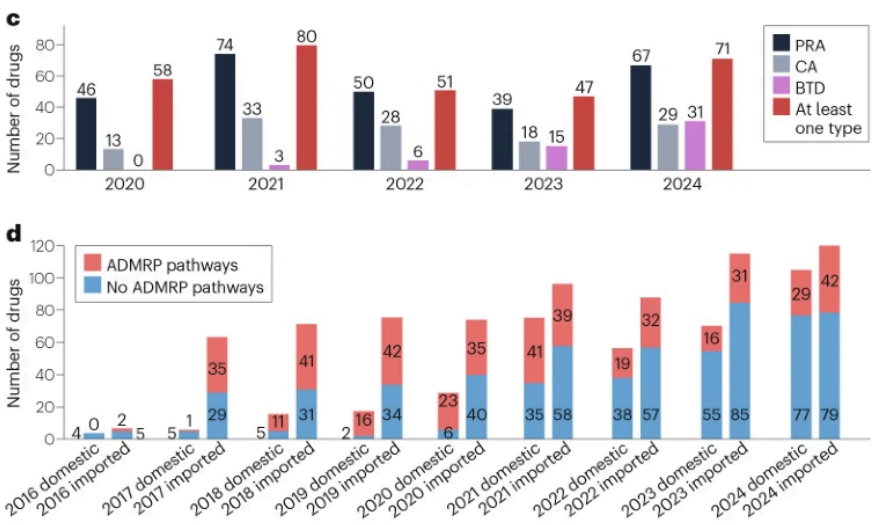
2016-2024年NMPA批准上市新药数量:a, 按药物类型分类; b, 按药物审评审批类型分类; c, 通过药品加快上市注册程序批准情况,“PRA”指优先审评审批、“CA”指附条件批准、“BTD”指突破性治疗药物、“At least one type”指通过至少一种药品加快上市注册程序批准上市的药物;d, 按药物来源分类。
新药审批时长
2016-2024年间通过加快上市注册程序获批上市的新药平均耗时422天,较非加快程序新药缩短147天。加快上市注册程序对进口药(缩短167天)的加速效果优于国产药(缩短110天);化学药平均审评时间缩短192天,生物药缩短79天。
2016-2019年,约88%通过加快上市注册程序获批新药在两年内完成审评审批,而约59%非加快程序药物需三年以上;2020-2024年,两类药物两年内完成审评审批的比例分别提升至94%和86%。
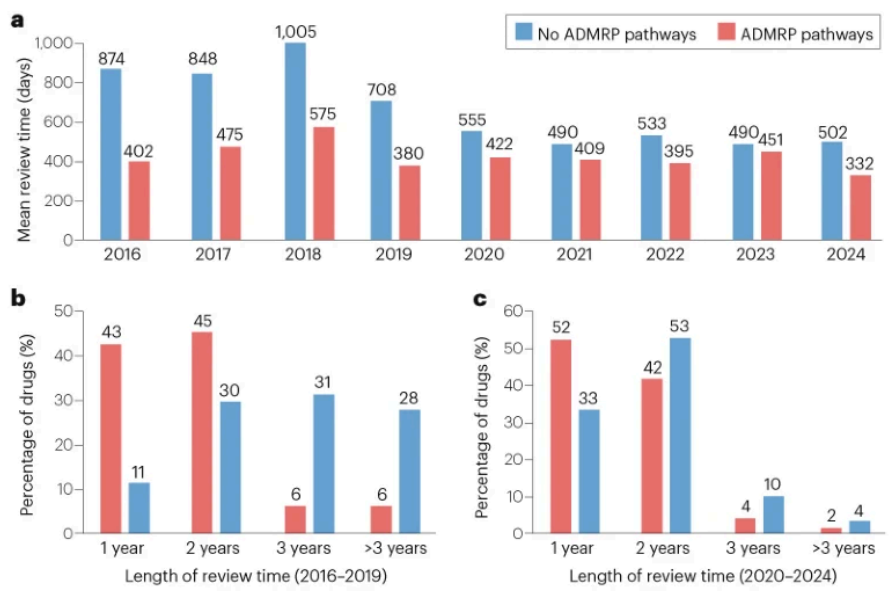
2016-2024年NMPA批准上市新药审评时间:a, 按药物审评审批类型分类;b, 2016-2019年NMPA批准上市新药审评时间分布情况; c, 2020-2024年NMPA批准上市新药审评时间分布情况。
治疗领域
肿瘤治疗领域是中国制药企业药物研发的重点。2016-2024年NMPA批准的1100个新药中:抗肿瘤药物占比最高(382个,35%),其次是内分泌代谢药物(128个,12%)、抗感染药物(96个,9%)、神经系统疾病药物(94个,9%)、呼吸系统疾病药物(50个,5%)以及其他领域药物合计占32%。
通过加快上市注册程序(ADMRP)获批的药物中:抗肿瘤药物达219个(48%),显著高于非加快程序的163个(25%)。其次是抗感染药物(44个,10%)和神经系统疾病药物(39个,9%)。
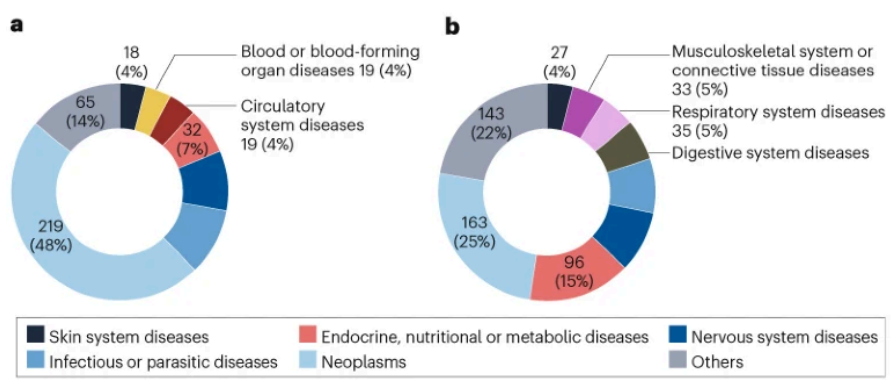
2016-2024年NMPA批准上市新药治疗领域分布情况:a, 通过药品加快上市注册程序批准情况;b, 通过非药品加快上市注册程序批准情况。
结语
中国药品加快上市注册程序(ADMRP)为新药快速审批奠定基础,平均审评时间缩短147天。持续深化的药品监管改革成效显著。未来需进一步扩大加快审批药物的治疗领域覆盖,这对满足临床急需、保障患者健康权益具有关键意义。


