免疫治疗在多种癌症的临床治疗中取得良好的效果和持久的临床反应。然而,该方案仅适用于小部分患者,如anti-PD-1(pembrolizumab)在三阴性乳腺癌(TNBC)中的响应率仅为18.5%。免疫调节药物为增强抗肿瘤免疫应答提供了重要机遇,然而这些药物必须高效到达肿瘤病灶并长时间滞留才能更好地发挥疗效。由于肿瘤组织的高度异质性以及瘤内错综复杂的递送屏障,靶向肿瘤的药物递送受到严重限制而且极易从病灶部位清除,严重限制了免疫调节效应的发挥。因此,如何提高肿瘤靶向递送效率、延长滞留时间从而增强抗肿瘤免疫应答成为肿瘤免疫治疗的关键难题。
近日,《先进材料》(Advanced Materials)杂志以“Extracellular matrix-trapped bioinspired lipoprotein prolongs tumor retention to potentiate antitumor immunity”为题,在线发表了复旦大学药学院张志文研究员、高原副研究员和中国科学院上海药物研究所李亚平研究员团队合作的最新研究成果。该工作提出并证实利用肿瘤基质捕获型仿生脂蛋白系统,通过与肿瘤基质的特异性结合延长肿瘤滞留时间以增强抗肿瘤免疫应答的新策略。
研究发现:与正常组织相比,乳腺癌肿瘤基质(ECM)中腱蛋白C(TNC)、纤连蛋白(FN1)以及成纤维细胞激活蛋白酶(FAP)异常上调,基于此,本研究设计了一种FAP酶响应的可特异性结合TNC和FN1的多肽,进而构建肿瘤基质捕获型仿生脂蛋白系统(FTF-BL-CP),其与TNC和FN1的选择性结合能力比与胶原蛋白I(COL1)、透明质酸(HA)的结合性能高2个数量级,能够高效递送抗肿瘤药物卡巴他赛和免疫调节药物泊马度胺,实现在肿瘤部位蓄积和深部渗透,利用与肿瘤基质中TNC和FN1特异性结合延长滞留时间,进而增强抗肿瘤免疫应答。与对照相比,该策略使肿瘤病灶中CD3+CD8+ T细胞以及表达interferon-γ-, granzyme B-, perforin-以及Ki67的亚型分别提高6.96-, 9.24-, 6.72-, 7.32-, and 6.73-,显著改善TNBC治疗效果。
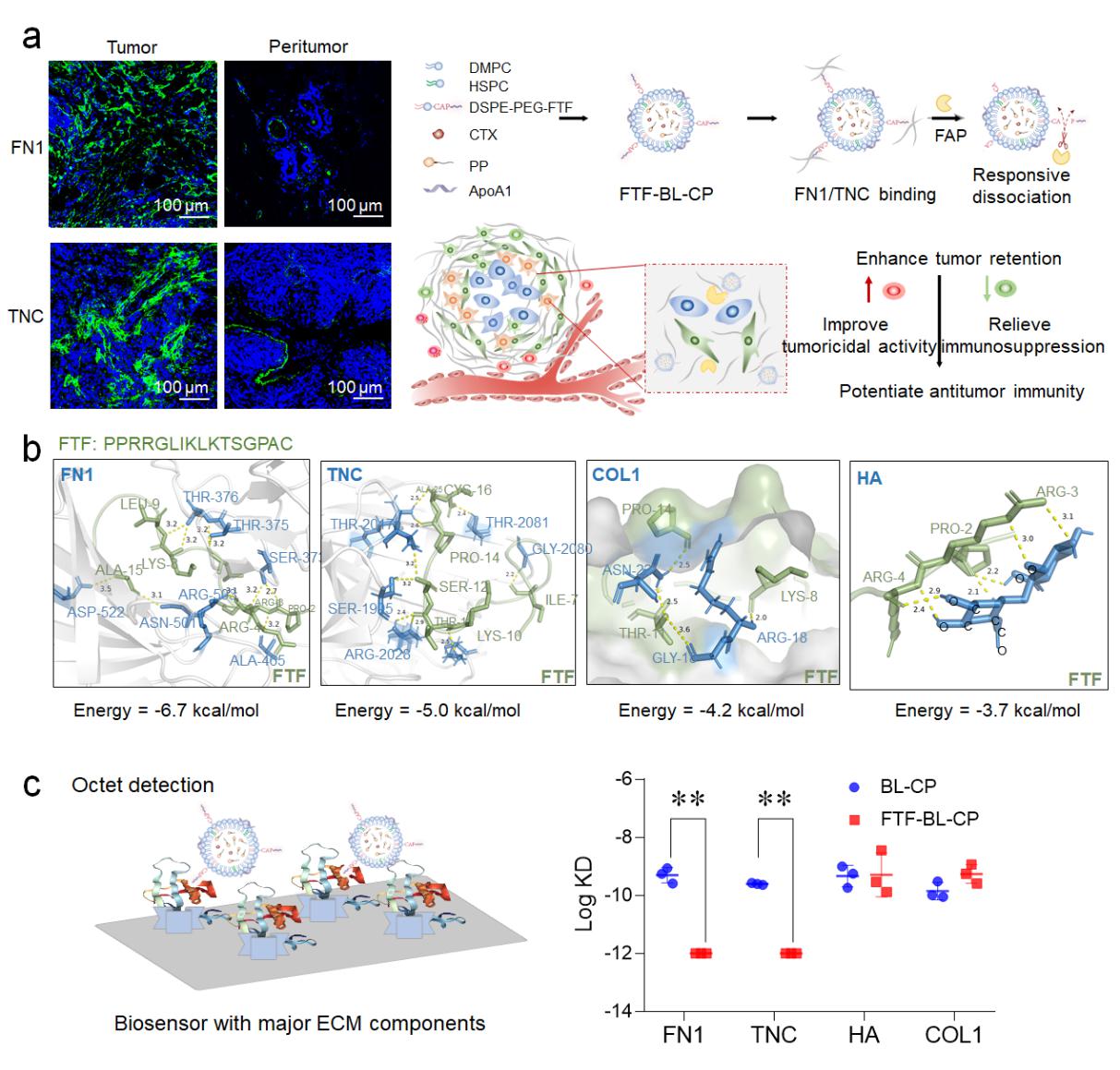
图1肿瘤基质捕获型仿生脂蛋白系统FTF-BL-CP的设计思路及与肿瘤基质中TNC和FN1特异性结合的评价

图2 FTF-BL-CP与乳腺癌肿瘤基质中TNC和FN1特异性结合,进而增强抗肿瘤免疫应答、抑制肿瘤生长
本研究提出的肿瘤基质捕获型仿生脂蛋白系统为基于肿瘤临床关键病理特性构建治疗系统,进而增强抗肿瘤免疫应答的研究提供了一种新思路,并为改善乳腺癌临床治疗提供一种新探索。
复旦大学药学院张志文研究员、高原副研究员和中国科学院上海药物研究所李亚平研究员为本文共同通讯作者。复旦大学博士研究生吴瑶、上海市浦东医院李永平副主任医师、复旦大学人工智能创新与产业学院胡子欣副研究员和中国科学院上海药物研究所研究生李媛为共同第一作者。该研究获得了科技部和国家自然科学基金等的资助。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202310982。


