在可切除的实体瘤治疗中,手术仍是基础且关键的干预方式。然而对于如脑胶质瘤等位于中枢神经系统、边界模糊的高侵袭性肿瘤,往往难以彻底清除微小残留病灶,导致复发高发。当前的局部治疗策略(如免疫治疗、纳米药物)虽展现出前景,但依然面临药物难以精准驻留、系统毒副作用大等难题,疗效受限。
近日,复旦大学药学院黄容琴教授联合哈佛大学医学院陶伟教授在Cell Biomaterials杂志上发表了题为:“Modulating nano-bio interface via drug-framework hybridization to activate chemoimmunotherapy against glioma postoperative recurrence”的研究性论文。该工作开发了一种药物-框架杂化型纳米材料DHSF,通过结合化疗与免疫治疗,为抑制肿瘤术后复发提供了安全、长效的局部治疗方案。DHSF是一种独特的有机-无机杂化材料,通过将化疗药物杂化进介孔框架,实现了高度稳定的骨架内嵌,使药物在肿瘤微环境中缓慢降解,实现低剂量、超长持续释放,显著降低毒性并精准抑制免疫检查点(如PD-L1)。同时,DHSF通过增强与TLR4受体的结合,激活TLR4-NFκB信号通路,刺激免疫细胞分泌趋化因子,进一步增强抗肿瘤免疫反应。更值得关注的是,DHSF展现出优异的组织黏附性与止血能力。基于此特性,研究团队进一步开发了光固化凝胶制剂,可实现术中腔隙即时填充,形成“药物免疫仓”,持续提供局部化疗与免疫激活,实现术后复发精准干预。动物实验结果表明,该凝胶剂在脑胶质瘤术后模型中可显著延缓肿瘤复发,延长生存期;同时展现出优良的生物相容性及代谢清除特性,未见心肝肾等重要脏器毒性反应,验证了其在术中即用、术后缓释、术后免疫调控等多重临床潜力。
本研究所提出的 DHSF 杂化策略不仅优化了传统纳米药物的生物界面性能与药物释放行为,更为术后局部联合治疗提供了全新设计思路。其适应症潜力也有望扩展至如肝癌、胰腺癌、卵巢癌等其他高复发性实体瘤术后管理,为相关领域的临床转化研究提供坚实支撑。
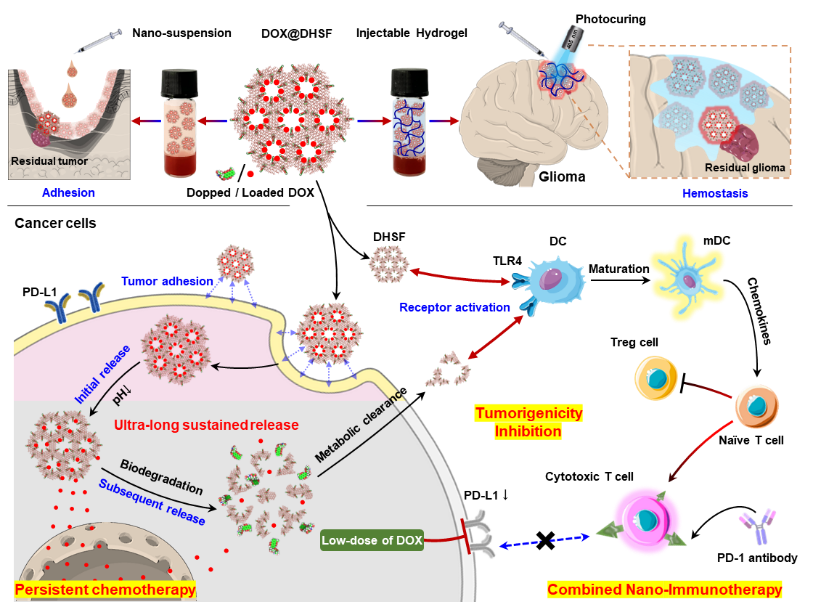
图1. 药物-框架杂化策略示意图:展示了DHSF的设计过程和机制,包括小分子药物与介孔骨架协同杂化形成有机-无机一体化结构,并可设计为局部注射的纳米悬液或植入后光固化的凝胶剂,以适应术后创腔内不同治疗需求。该系统可在肿瘤微环境中响应降解,实现药物持续释放、免疫激活与复发抑制等多重治疗功能。
复旦大学药学院博士生钱敏、硕士生蒋光伟和哈佛大学医学院Senfeng Zhao为本文共同第一作者,陶伟教授和黄容琴教授为本文共同通讯作者。该研究得到了国家自然科学基金、上海市科技创新计划等项目的支持。
论文链接:https://www.cell.com/cell-biomaterials/fulltext/S3050-5623(25)00016-9


