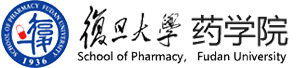胶质瘤是最常见的颅内原发恶性肿瘤,约占所有恶性脑肿瘤的80%,具有复发率高、死亡率高和治愈率低等特点。手术是胶质瘤治疗首选方案。但由于胶质瘤脑内浸润性生长特性,外科医生往往难以在术中准确界定胶质瘤边界并引导切除,导致胶质瘤术后高复发率。目前临床使用的磁共振和术中荧光等胶质瘤定位技术主要基于癌细胞导致血管结构破坏,其勾勒的是血脑屏障破坏区域,而不是胶质瘤真实边界。由于胶质瘤边缘癌细胞密度降低,削弱了癌细胞靶向成像技术的特异性和灵敏度,导致胶质瘤浸润区域的准确定位面临挑战。因此,发展术中定位胶质瘤浸润区域新策略对于改善手术预后具有重要意义。近日,复旦大学药学院李聪教授课题组提出可视化免疫抑制巨噬细胞定位胶质瘤浸润边界新策略,并基于此策略开发了一种近红外荧光探针,实现了胶质瘤术中影像导航,相关工作以“Intra-operative Definition of Glioma Infiltrative Margins by Visualizing Immunosuppressive Tumor Associated Macrophages”为题在线发表于《先进科学》(Advanced Science)杂志。
为了找到能够准确划分胶质瘤浸润边缘的可靠生物标志物,李聪教授团队分析了TCGA数据库中的胶质瘤标本数据,结果显示高级别胶质瘤中免疫抑制型细胞和因子表达含量更高(图1A),且抑炎表型肿瘤相关巨噬细胞(M2-TAM)在24种免疫细胞中的数量占比最高(图1B)。TCGA数据分析表明,M2-TAM在胶质瘤的含量显著高于正常组织(图1C),且与胶质瘤恶性级别呈正相关(图1D)。图1E的生存曲线表明M2-TAM含量高的病人生存期明显更短,ROC曲线预测M2-TAM作为胶质瘤患者诊断依据具有可靠性(图1F)。最后,他们通过对胶质瘤患者肿瘤样本进行H&E和免疫组化染色,结果显示CD68和CD206阳性巨噬细胞在胶质瘤边缘聚集(图1G)。因此,他们假设M2-TAM可能作为新的肿瘤标志物。
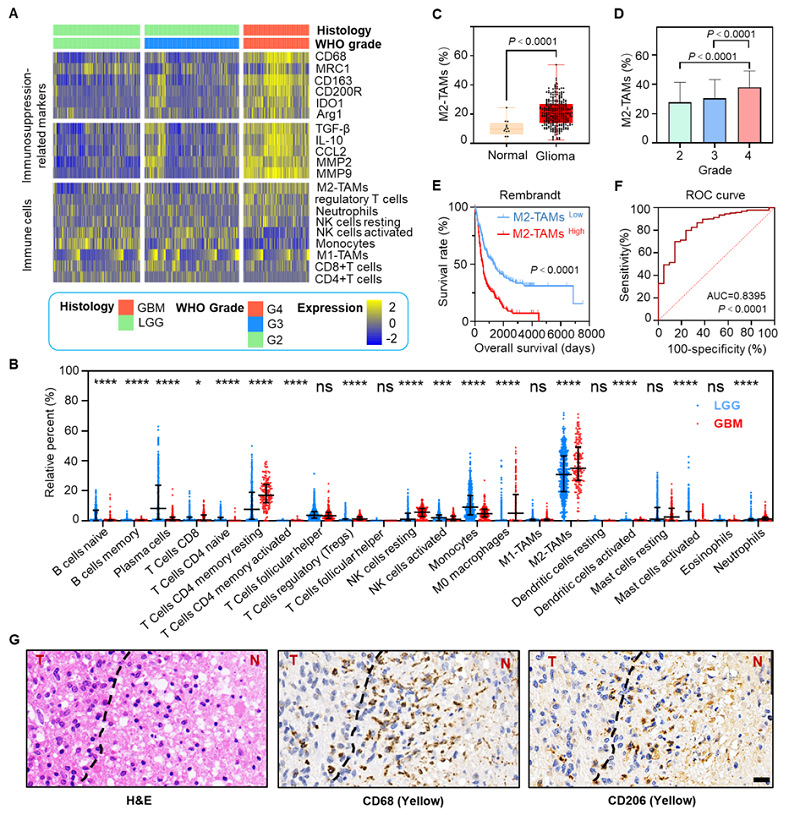
图1. 免疫抑制巨噬细胞(M2-TAMs)聚集在胶质母细胞瘤(GBM)浸润边缘。(A)热图显示TCGA-胶质瘤队列中的免疫特征。(B) TCGA 数据库显示低级别胶质瘤(LGG)与 GBM中的M2-TAMs在22种免疫细胞的相对百分比均为最高。(C)胶质瘤患者组织中M2-TAMs含量显著高于正常脑组织。(D)M2-TAMs 含量与胶质瘤的恶性程度(WHO分级)呈正相关。(E) Rembrandt 数据库中M2-TAMs百分比低(蓝色)和高(红色)的胶质瘤患者总生存率的 Kaplan-Meier 生存曲线。(F) 预测胶质瘤患者诊断的ROC曲线。(G)胶质瘤患者肿瘤样本的H&E、CD68 和 CD206 免疫组化染色图片。
为定位胶质瘤浸润边界,设计并合成了一种具有分层次靶向性的近红外荧光探针CP2-M,它由乙基哌嗪取代的 IR783 荧光团和通过聚乙二醇PEG 2K作为键连基团的靶向配体甘露糖组成(图2A)。图2B展示的参比探针包括CP2(pH响应型小分子荧光团)、CP2-P(经PEG 2k修饰的pH响应荧光团)和CB-M(经甘露糖修饰但无pH响应荧光团)。然后基于B3LYP/6-311 G (d,p) 水平离散傅里叶变换(DFT)计算CP2的HOMO和HOMO-1能级(图2C),结果显示质子化的探针被抑制分子的PET作用,导致探针的荧光强度发生变化。然后,他们在不同pH缓冲液中测试CP2-M的吸收光谱和发射光谱,并确定了他们的荧光强度比(I740/I670 nm)与pH值的线性关系(图2D-2G)。为了验证甘露糖配体的靶向性,他们采用表面等离子体共振(SPR)测试了PEG2K-甘露糖配体和修饰PEG2K-甘露糖配体的CP2-M在0.78 μM至12.5 μM 浓度范围内与 CD206 结合的亲和力(图2H, 2J)。SPR结果显示修饰甘露糖配体的CP2-M与CD206具有良好的亲和力(图2I, 2K),表明CP2-M可以靶向甘露糖受体CD206。

图2. 探针CP2-M的合成和表征。(A) 质子化和去质子化形式的 CP2-M 的化学结构。(B) 参比探针的化学结构,包括小分子CP2、PEG修饰的 CP2-P,以及PEG和甘露糖修饰但无 pH响应的 CB-M。(C)基于B3LYP/6-311 G (d,p) 水平DFT计算的CP2 的HOMO 和 HOMO-1 能级。CP2-M 的吸收光谱(D)和发射光谱(E-F)与 pH 值的关系。 (G)CP2-M的荧光强度比(I740/I670 nm)与 pH 值的线性关系图。 (H-K) PEG2K-甘露糖配体(H,I)和 CP2-M(J,K)在 0.78 μM 至 12.5 μM 浓度范围内与 CD206 结合的表面等离子体共振(SPR)亲和力图。
为了测试探针在细胞水平的成像效果,在骨髓来源的巨噬细胞中评估了探针 CP2-M 的靶向能力(图3A)。首先考察了参比探针CP2、CP2-P和CP2-M在M2-Mφ中的摄取能力,通过用甘露糖提前进行受体阻断作为对比,证明了修饰甘露糖的CP2-M可以靶向M2-TAMs(图3B, 3D)。然后将CP2-M与不同表型的巨噬细胞共孵育,进一步验证了探针通过CD206受体靶向M2-TAMs(图3C, 3E)。图3F的溶酶体共定位实验表明CP2-M进入细胞后到达溶酶体,探针与不同表型巨噬细胞共孵育的pH mapping表明M2-TAM的吞噬体为酸性,而M1-TAM的吞噬体为中性(图3H-3I)。上述实验表明CP2-M可以通过CD206靶向M2-TAMs,然后响应吞噬体酸性实现对M2-TAMs的特异性识别。

图3. 目标探针CP2-M特异性地识别M2-Mφ。(A) 小鼠骨髓中分离的巨噬细胞的极化为不同表型的示意图。(B) CP2、CP2-P 或 CP2-M 与M2-MΦ共孵育后的荧光共聚焦显微镜图像。(C) 用 CP2-M处理 C6、M0-Mφ、M1-Mφ 和 M2-Mφ后的荧光共聚焦图像。 (D-E) 通过流式细胞仪统计分析CP2-M 在细胞内的平均荧光强度(MFI)。(F) 分别用 CP2-M 和 Lysotracker 处理巨噬细胞的荧光图像。(G)CP2-M 被M2-TAMs特异性摄取并响应溶酶体酸性的示意图。(H)CP2-M在巨噬细胞内的比率型荧光图像pH mapping。(I)CP2-M定量M1-Mφ 和 M2-Mφ内吞噬体的pH。
为了考察探针CP2-M在动物体内的性质,他们建立了PK/PD模型进行体内药代动力学研究(图4A)。首先考察了CP2、CP2-P、CB-M和CP2-M在活体内的药动学性质,PEG的修饰显著延长了小分子探针CP2在体内的循环时间,而甘露糖等配体对于体内循环时间几乎没有影响,模拟探针浓度与实测的数据具有相同的趋势和变化(图4B)。然后将上述几种探针分别通过尾静脉注射到小鼠体内观察脑部肿瘤信号,活体成像结果表明CP2-M在脑肿瘤具有最高的信噪比,且荧光强度在4 h达到峰值(图4C-4E)。探针在体内的生物分布显示修饰甘露糖的CB-M和CP2-M具有肿瘤靶向作用,CP2-M比未标记pH响应基团的CB-M具有更高的信噪比(图4F-4G)。
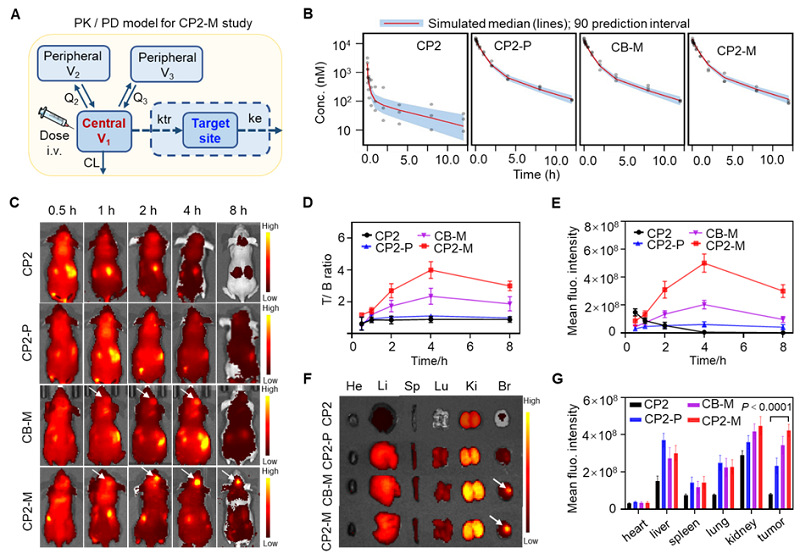
图4. 目标探针CP2-M高信噪比定位GBM模型。(A)荧光探针的PK/PD模型示意图。(B) PK模型预测显示,模拟的探针浓度与实测的数据具有相同的趋势和变化。灰色圆点是实测数据,红色实线表示预测的中位数,蓝色区域表示模型模拟的 90% 预测区间。(C) 荷胶质瘤小鼠模型在静脉注射 CP2、CP2-P、CB-M 或 CP2-M后的活体荧光成像。肿瘤部位的 T/B 比率(D)和平均荧光强度(E)随探针注射后的时间变化关系。(F)注射 CP2、CP2-P、CB-M 或 CP2-M 8 小时后的生物分布。(G)肿瘤和主要器官的平均荧光强度定量分析。
他们进一步对手术开颅后荷胶质瘤大鼠进行活体荧光成像(图5A)。CP2-M和CB-M单次给药后肿瘤/正常组织(T/B)比率随注射后时间逐渐升高,且在脑肿瘤富集,在4 h达到峰值(图5B)。基于定量药理学的药动(PD)模型预测显示,模拟的T/B比率信号与实测数据具有相同的趋势和变化(图5C)。他们定义T/B 值大于3作为理想的成像效果,CP2-M展示出长达6 h的理想手术时间窗口(图5D)。
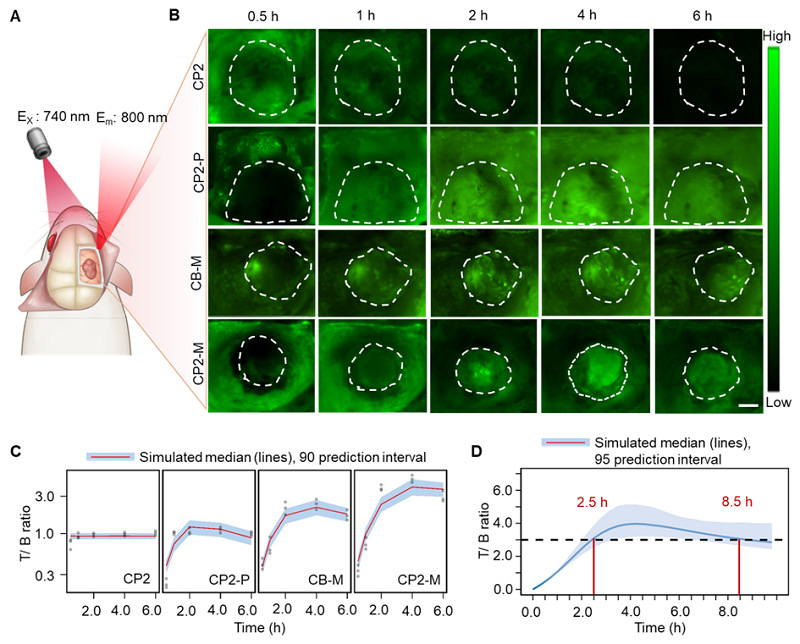
图5. 目标探针CP2-M术中勾勒大鼠胶质瘤模型。(A) 颅内胶质母细胞瘤体内成像的示意图。(B) 荷胶质瘤大鼠开颅后静脉注射 CP2、CP2-P、CB-M 或 CP2-M(5.0 μmol/kg)的荧光图像。肿瘤边界以白色虚线划出,比例尺:2.0 mm。(C) PD模型预测显示,模拟的 T/B 比率信号与实测数据具有相同的趋势和变化。(D) CP2-M(5.0 μmol/kg)单次给药后T/B 比率随时间变化的趋势图。黑色虚线表示术中成像理想的 T/B 值,两条红线之间的时间段是理想的手术时间窗口。
为了验证CP2-M对于胶质瘤边界成像的优越性,将临床常用的吲哚花青绿(ICG)、5-ALA与CP2-M通过尾静脉先后注射到同一只荷瘤鼠体内进行荧光成像对比(图6A-6E)。术后该脑肿瘤的H&E染色结果证实了CP2-M对于胶质瘤边界的定位比ICG和5-ALA更加准确(图6F-6I)。免疫组化染色表明CP2-M界定的肿瘤边缘中M2-TAMs含量最高(图6J-6O),且该组织边缘的流式分析显示出M2-TAMs的探针含量高于肿瘤细胞,进一步证明CP2-M靶向进入肿瘤边缘的M2-TAMs(图6Q)。
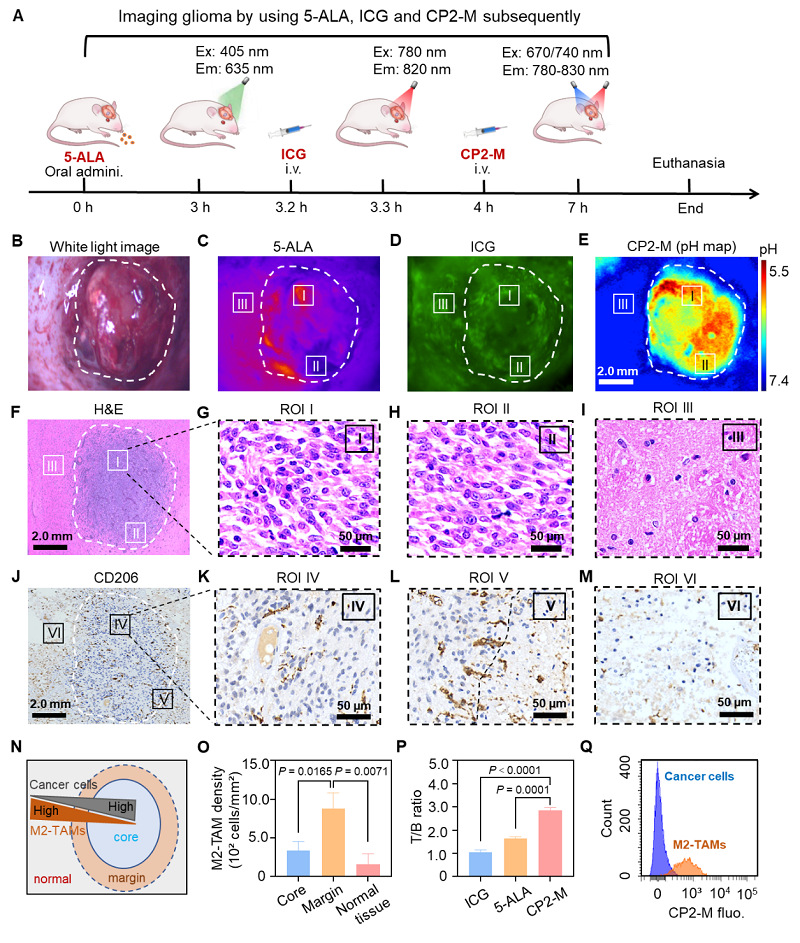
图 6. CP2-M靶向M2-TAMs定位GBM边界。(A)三种荧光探针对同一大鼠GBM模型进行活体荧光成像的流程图。(B)开颅后的脑肿瘤白光图、(C)口服 5-ALA、(D)静脉注射 ICG后肿瘤区域的荧光图像以及(E)静脉注射 CP2-M 后的 pH mapping图。(F) 对应大鼠胶质瘤(B)切片的H&E 染色图像以及 I 区(G)、II 区(H)和 III 区(I)的放大图像,比例尺:2.0 mm 和 50 μm(放大)。(J)肿瘤及周围区域 CD206+ TAMs 的免疫组织学染色。CD206+TAMs在IV区(K)、V区(L)和VI区(M)的空间分布。(N)胶质瘤中M2-TAMs和癌细胞的空间分布示意图。(O)肿瘤不同区域的 M2-TAMs 密度。(P)三种探针对于荷瘤鼠GBM成像的T/B 比率统计图。(Q)给药4小时后从肿瘤组织中分离的癌细胞和 M2-TAMs 细胞内CP2-M的流式定量分析。
继而将该探针CP2-M应用于原位胶质瘤大鼠模型的手术切除。经C6胶质瘤细胞注入SD大鼠脑内造模成功后,打开颅骨和脑膜暴露肿瘤组织进行活体荧光成像(图7A),根据术中实时生成pH map图导航胶质瘤手术切除。可以看到随着手术的进行,酸性区域不断被切除,直至所有pH<7.0的区域均被切除(图7B)。在大鼠胶质瘤切片中,发现了肿瘤细胞、免疫抑制性的M2-TAMs和Treg细胞密度与酸化的相关性(图7C-7H)。

图 7. CP2-M通过勾勒肿瘤切缘pH图引导手术。(A) 荷C6胶质瘤大鼠模型建立、成像和组织分析的流程图。(B) CP2-M描绘的pH图实时引导下进行颅内胶质瘤的手术切除。不同pH肿瘤组织的(C)H&E 染色和(D)细胞密度统计。不同pH肿瘤组织中免疫抑制型M2-TAMs(E, F)和 Tregs(G, H)含量的流式细胞分析。
完成手术切除后,他们利用磁共振(MRI)监测各实验组大鼠术后复发情况(图8A-8B),并根据MRI影像计算大鼠肿瘤体积变化,ICG和5-ALA导航组复发的肿瘤体积呈现近似指数型增长,而CP2-M导航组的大鼠模型术后复发速度显著低于其他探针导航组(图8D)。各组术后大鼠脑组织的病理切片染色证明磁共振监测大鼠术后复发情况的可靠性(图8C)。在生存率方面,CP2-M导航组75%的动物模型实现肿瘤完全切除,生存时间超过100天,显著高于其他两种临床常用探针导航组(图8E)。行为学实验方面,转棒和平衡木实验表明CP2-M引导胶质瘤切除对于术后小鼠的运动协调能力没有显著影响(图8F-8H),图I的Y迷宫实验证明该手术切除没有造成明显的神经损伤。因此,CP2-M介导的免疫抑制边界导航显著改善大鼠胶质瘤模型的手术预后。
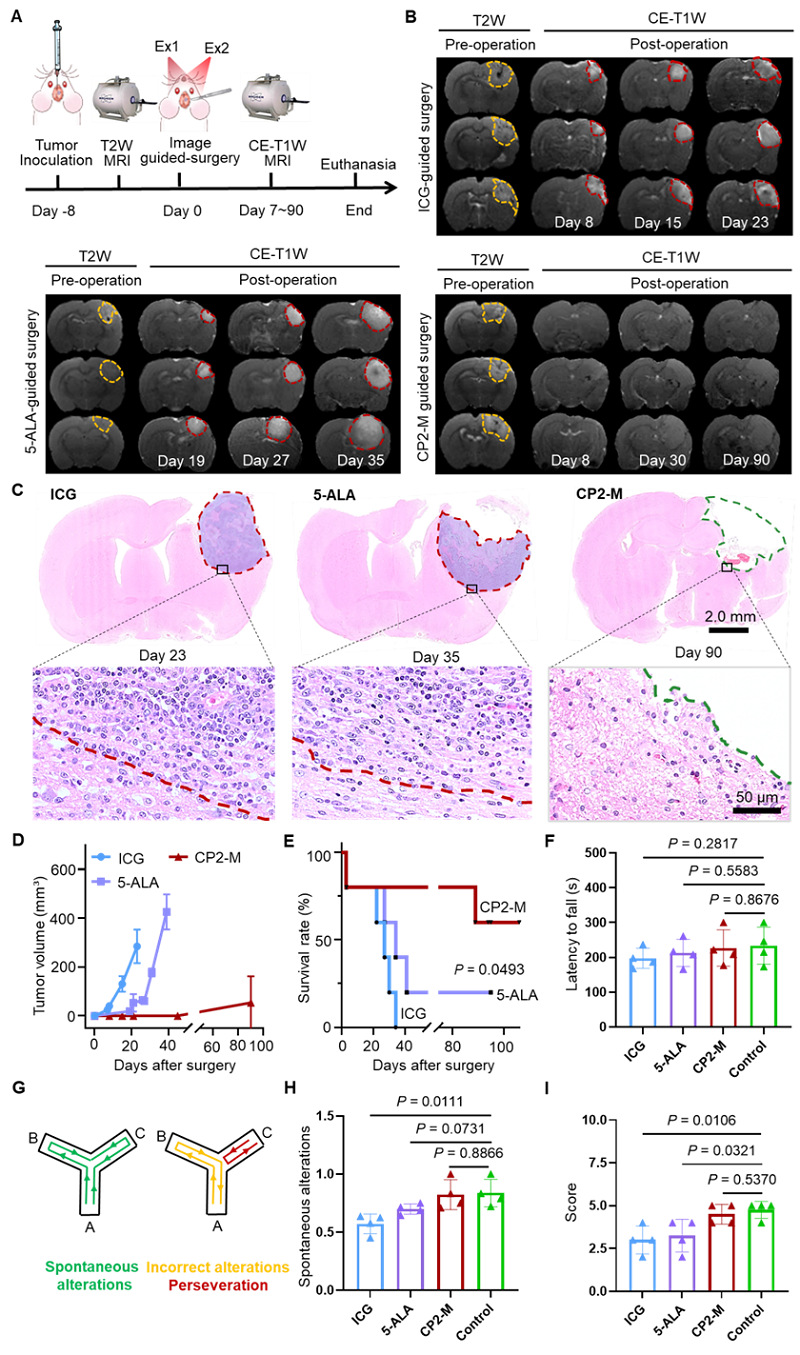
图 8. CP2-M引导胶质瘤切除降低肿瘤复发率。(A)对荷胶质瘤大鼠模型进行图像引导手术切除并监测肿瘤复发的实验进程表。(B) 荷胶质瘤大鼠模型在 ICG、5-ALA或CP2-M引导手术切除后的磁共振检测复发图像。(C) 实验结束时术后大鼠脑切片的H&E 染色图像。红色虚线表示手术后肿瘤复发,绿色虚线表示未复发的肿瘤切除床。术后大鼠模型(D)复发肿瘤体积和(E)Kaplan–Meier生存曲线(n = 5)。(F)ICG、5-ALA 或 CP2-M 引导小鼠胶质瘤手术切除后的转棒实验。(G)Y-迷宫试验中自发交替(左)和不正确交替(右)的示意图。(H)荷瘤鼠术后的Y-迷宫试验自发交替表现。(I)术后小鼠在平衡木行走试验中的得分表现。
总结:
本工作通过分析胶质母细胞瘤(GBM)患者的标本揭示了M2-TAMs在胶质瘤浸润边缘的聚集,并基于此提出了通过在术中可视化M2-TAMs而非癌细胞来界定胶质瘤边缘的分层靶向策略。基于上述策略进一步开发了pH比率响应的荧光靶向探针CP2-M,CP2-M首先靶向胶质瘤浸润边界富集的M2-TAMs,并通过感知细胞酸性吞噬小体来特异性识别M2-TAMs。通过与目前临床上使用的成像探针相比,该探针在动物水平可明显改善手术预后。本研究的创新点在于:(i) 提出了一种新策略,通过靶向抑炎表型肿瘤相关巨噬细胞(M2-TAMs)而不是癌细胞来勾勒胶质瘤浸润边缘,从而避免了肿瘤边缘癌细胞密度降低而导致的假阴性。(ii) 开发了一种分层靶向探针CP2-M来定位M2-TAMs。CP2-M首先靶向M2-TAMs 上特异表达的 CD206 受体,然后响应内化后的吞噬体酸性。该策略显示更高的肿瘤信噪比;(iii) 与临床使用的探针(包括吲哚菁绿(ICG)和 5-氨基乙酰丙酸(5-ALA))相比,这种分层靶向策略可改善胶质瘤异体移植大鼠模型的手术预后。
复旦大学药学院博士生曹崇、尹航、华山医院神经外科主治医师岳琪、华山医院博士生杨标是该论文的共同第一作者。复旦大学附属华山医院毛颖教授、复旦大学类脑智能科技研究院张孝勇研究员、复旦大学药学院朱校青年研究员、雷祖海青年研究员、李聪教授为该论文通讯作者。该研究同时得到了复旦大学信息学院余锦华教授的大力支持。该研究工作得到了国家自然科学基金、上海市科委生物医药领域科技支撑项目等资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202304020