关键词:癫痫手术,表面增强共振拉曼技术,SPECT成像,自组装单层,低密度脂蛋白受体相关蛋白-1
癫痫是一种常见的神经系统疾病,全球患病率约1%。目前临床上主要通过长期规范、合理服用抗癫痫发作药(ASDs)控制疾病发作。近年来,新型ASDs不断涌现,但是仍有约三分之一的癫痫患者经规范的药物治疗无法获得发作控制或缓解,因而被诊断为难治性癫痫。当前,手术切除致痫灶是难治性癫痫最有效的治疗手段,而癫痫手术成功的关键在于致痫灶的精准定位。磁共振成像(MRI)通过发现脑组织结构异常定位致癫灶,然而约30%难治性癫痫患者脑部MRI影像未能展示明显异常。此外,开颅后脑漂移也会造成导致术前致痫灶影像失真。颅内脑电可检测神经元异常电活动,是致痫灶定位的金标准,但因存在空间分辨率低、耗时长、费用高昂、易受麻醉影响等缺点,限制其在临床实践中的应用。鉴于当前致痫灶定位技术的诸多不足,全球仅有不到1%的癫痫患者从手术治疗中获益。因此,开发可术前、术中一体化准确定位致痫灶的成像技术,是提高难治性癫痫患者治疗预后的关键。
近日,复旦大学药学院李聪教授联合复旦大学附属华山医院神经外科陈亮教授、复旦大学工程与应用技术研究院王聪博士后在ACS Appl Mater & Interfaces(美国化学学会应用材料与界面)杂志上发表了题为:“Guiding Epilepsy Surgery with an LRP1-targeted SPECT/SERRS Dual-mode Imaging Probe”(SPECT/SERRS双模成像探针靶向LRP1引导癫痫手术)的论著。该工作构建了一类靶向低密度脂蛋白受体相关蛋白-1(LRP1)的SPECT/SERRS双模成像探针,此探针能够在LPR1的介导下跨越血脑屏障并靶向致痫灶。在癫痫小鼠模型中,该探针能帮助研究人员在癫痫手术开展前利用单光子发射计算机断层扫描技术(SPECT)获取致痫灶的位置信息,在术中利用表面增强共振拉曼技术(SERRS)勾勒致痫灶边界,准确引导致痫灶切除(图1)。
在这项工作中,研究团队以树枝状聚酰胺PAMAM为载体,将纳米金连接基团硫辛酸、近红外七甲川花菁染料Cy7-Cl、放射性金属鳌合分子DTPA、亲水性聚合物PEG以及靶头Angiopep-2依次连接在PAMAM上,构建一类可调节的“自组装单层(SAM)”样拉曼报告分子。进一步,通过一步混合法与自制的纳米金星结合得到ACS@AuS,而后标记放射性核素99mTc即可得到一类SPECT/SERRS双模成像探针99mTc-ACS@AuS(图1)。
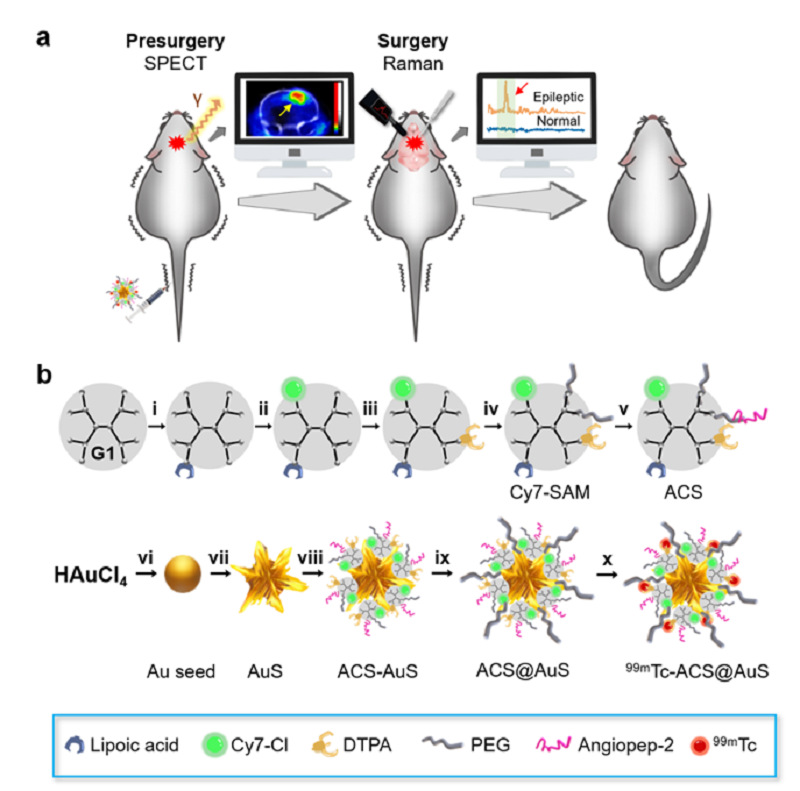
图1. 探针99mTc-ACS@AuS的设计与合成。(a)术前利用SPECT成像获取致痫灶位置信息,术中利用SERRS勾勒致痫灶边界并引导手术切除。(b)探针合成过程:(i)硫辛酸;(ii)Cy7-Cl;(iii)DTPA;(iv)MAL-PEG5K-NHS;(v)半胱氨酸修饰的Angiopep-2;(vi)柠檬酸钠;(vii)抗坏血酸,AgNO3;(viii)ACS;(ix)HS-PEG5K-OMe;(x)氯化亚锡,99mTcO4。
透射电镜显示ACS@Au呈多分支状星型结构,金核粒径约20 nm。探针水合粒径约59.9 nm,表面电荷呈近中性(+6.59 mV)。紫外吸收结果表明,相较于金纳米星AuS(850 nm),以及拉曼报告分子ACS(779 nm),ACS@Au在791 nm处出现了新的吸收峰。进一步,我们考察了ACS@AuS的拉曼光谱,311 cm-1处拉曼峰可归属为Au-S键的伸缩和弯曲振动;520和553 cm-1处尖锐双峰归属于亚甲基碳链的环变形;780和929 cm-1处的拉曼峰分别为亚甲基碳链的C-H面外弯曲振动及C-C对称伸缩。放射性标记探针99mTc-ACS@AuS具有较高的放射性纯度(大于99%)及良好的体外放射化学稳定性(图2)。
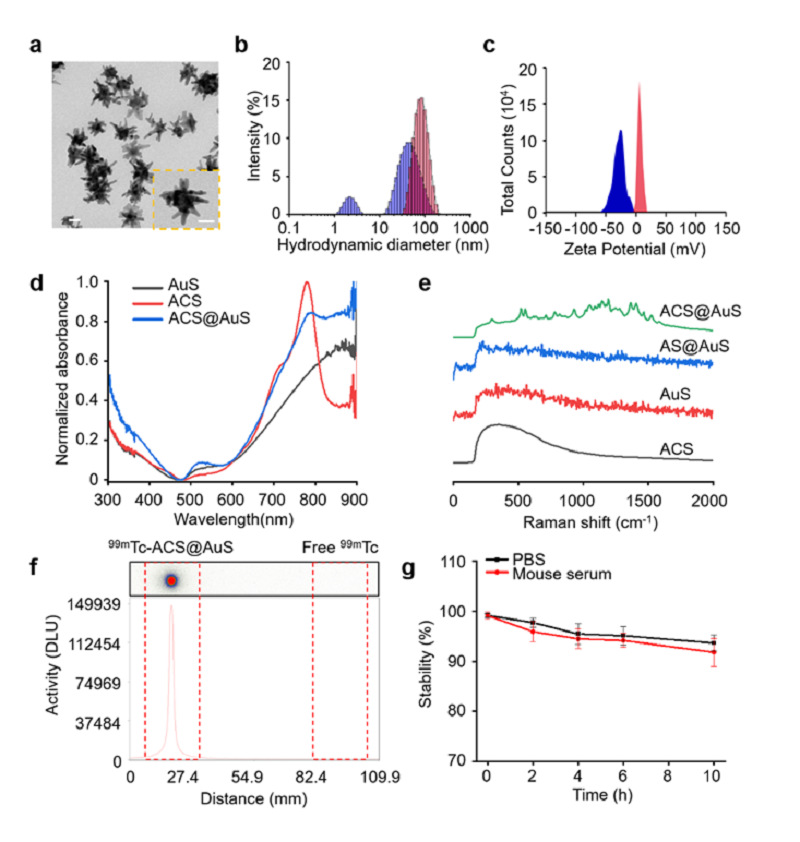
图2. 探针99mTc-ACS@AuS的表征。(a)ACS@AuS的TEM图。(b)AuS(蓝色)和ACS@AuS(红色)的水合粒径图。(c)AuS(蓝色)和ACS@AuS(红色)的Zeta电势。(d)AuS、ACS和ACS@AuS的紫外吸收光谱。(e)ACS、AuS、AS@AuS和ACS@AuS拉曼光谱。(f)99mTc-ACS@AuS的放射化学纯度大于99%。(g)99mTc-ACS@AuS在PBS(pH7.4)和小鼠血清中的放射化学稳定性。
常规拉曼报告分子在金纳米表面多呈无序排列,而基于SAM的拉曼报告分子通过分子间电荷排斥及分子亲水性,可以在纳米金表面获得更加有序规则的排列,表现出良好的拉曼光学性质:(1)以同一花菁类分子为研究模板,拉曼信号增长104.8 ± 21.8%;(2)ACS@AuS的拉曼信号强度稳定且批次间差异小(变异系数为± 3.7%);(3)ACS@AuS拉曼信号强度与浓度呈良好的线性相关性(图3)。
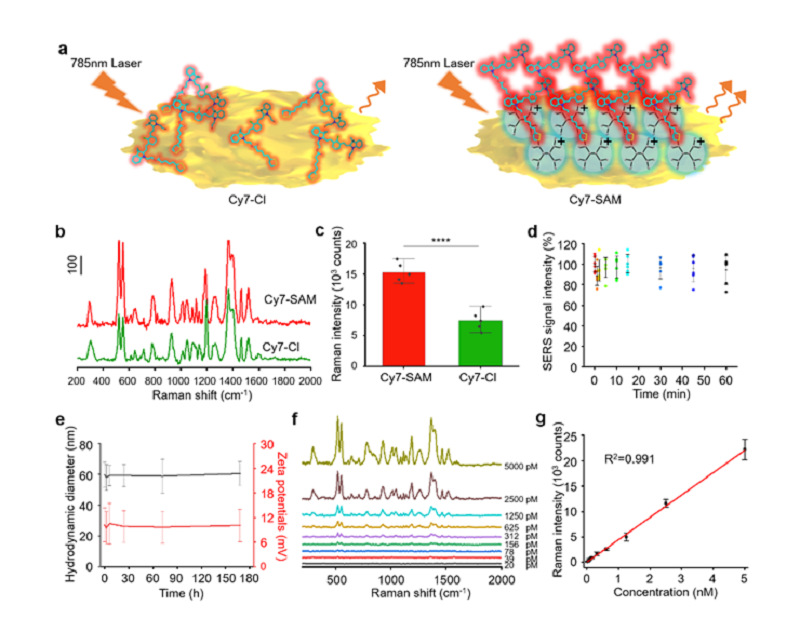
图3. ACS@AuS的拉曼成像性质。(a)拉曼信号增强的推测机制。(b)Cy7-SAM和Cy7-Cl的SERRS光谱(c)Cy7-SAM和Cy7-Cl拉曼信号强度的定量分析。(d)ACS@AuS SERRS光谱的光稳定性。(e)ACS@AuS在PBS中粒径及电荷稳定性。(f)ACS@AuS浓度依赖性拉曼光谱测试。(g)ACS@AuS拉曼信号强度和探针浓度之间呈线性相关。
研究团队通过构建体外血脑屏障(BBB)模型对探针跨BBB的能力及机制进行了初步论证。免疫荧光染色结果表明经脂多糖LPS处理后,LRP1在血管内皮细胞bEnd.3中的表达水平为处理前的2.09 ± 0.74倍。Transwell实验结果显示:与未经Angiopep-2修饰的99mTc-CS@AuS相比,Angiopep-2修饰的探针99mTc-ACS@AuS跨BBB效率显著提高(图4)。
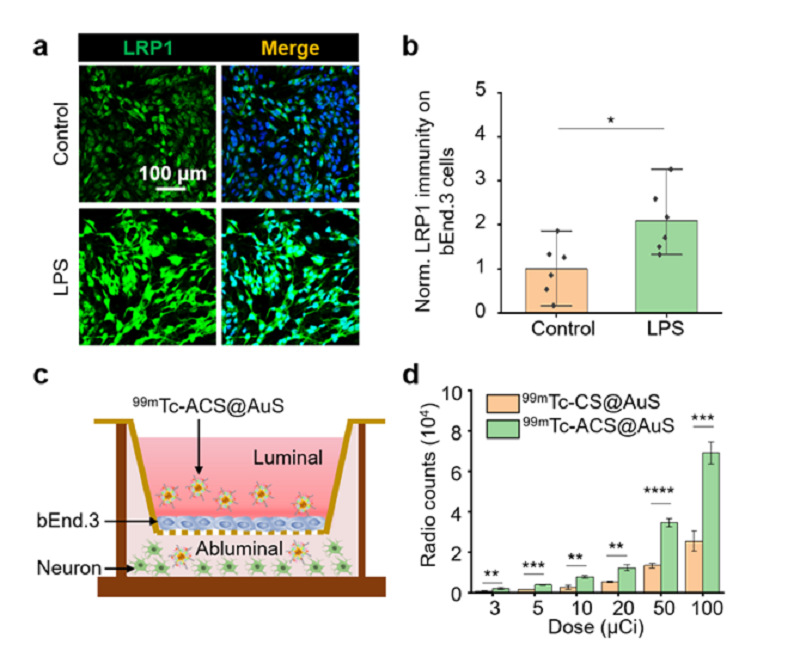
图4. 99mTc-ACS@AuS体外跨BBB效率高。(a)LPS或PBS处理bEnd.3的LRP1免疫荧光图像。(b) LRP1免疫荧光强度半定量分析。(c) 体外BBB模型示意图。(d) 放射性计数定量分析99mTc-ACS@AuS及99mTc-CS@AuS跨BBB的效率。
随后对探针靶向炎性胶质细胞(致痫灶)的能力及机制进行探索。首先考察了LRP1在小胶质细胞及星形胶质细胞上的表达,免疫荧光结果表明LPS处理后,小胶质细胞及星型胶质细胞LRP1表达水平分别为处理前的3.51±0.72倍和6.46±0.92倍。拉曼及放射性结果均表明,99mTc-ACS@AuS细胞摄取较非靶向的99mTc-CS@AuS显著增高。上述结果表明,以LRP1为靶点,既能大幅提高探针ACS@AuS的BBB穿透效率又能帮助探针对致痫灶进行有效定位(图5)。
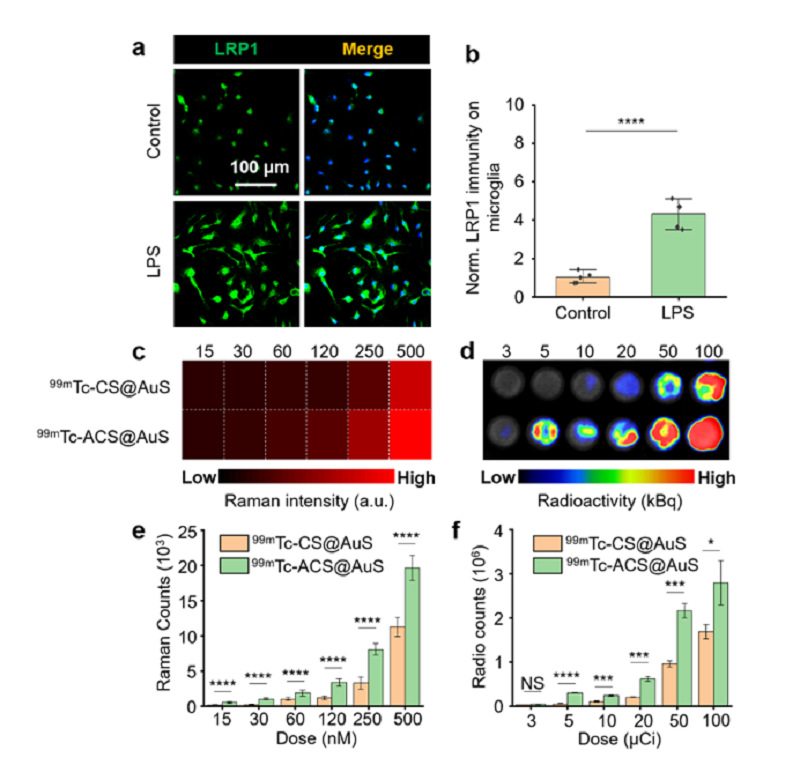
图5. 99mTc-ACS@AuS在炎性小胶质细胞中高摄取。(a)原代小胶质细胞经LPS或PBS处理后LRP1的免疫荧光染色图。(b)LRP1免疫荧光强度的半定量分析。(c)小胶质细胞的拉曼成像图像。(d)小胶质细胞的SPECT/CT成像图。(e)拉曼信号强度的定量分析。(f)SPECT信号强度的定量分析。
在体外研究基础上,通过海马原位注射海人酸构建难治型癫痫小鼠模型,对探针经SEPCT成像定位致痫灶的能力进行验证。颅骨脑电显示模型小鼠有明显的自发性阵发性的棘波。经尾静脉注射后,对癫痫小鼠进行SPECT成像,结果表明与非靶向99mTc-CS@AuS相比,99mTc-ACS@AuS在致痫灶处具有更高的放射性摄取(图6)。
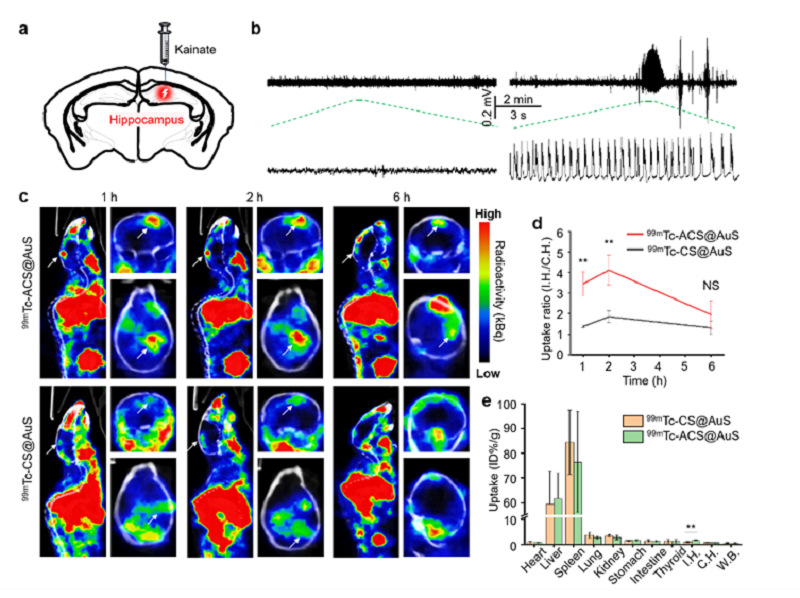
图6. 99mTc-ACS@AuS在体SPECT成像。(a)海人酸诱导癫痫小鼠模型示意图。(b)癫痫小鼠模型和对照小鼠的颅骨脑电图。(c)静脉注射探针后1、2、6小时癫痫小鼠SPECT/CT影像。(d)SPECT图中放射性信号定量分析(同侧海马/对侧海马)。(e)99mTc-ACS@AuS和99mTc-CS@AuS在癫痫小鼠体内的生物分布。
基于良好的体内外成像效果,研究团队对该探针活体引导小鼠致痫灶手术切除的疗效进行评估。在表面增强拉曼共振成像技术的引导下对癫痫小鼠致痫灶进行切除并在术后对小鼠进行脑电记录。膜片钳结果表明,99mTc-ACS@AuS特征拉曼峰强的脑组织中神经元兴奋性更高,同时该区域组织LRP1表达也更高。与假手术组和非靶向探针引导手术组相比,99mTc-ACS@AuS引导手术组小鼠术后癫痫发作次数明显减少且发作强度明显降低。因此,该探针可以在小鼠癫痫模型上实现致痫灶的术前定位及术中有效引导切除(图7)。
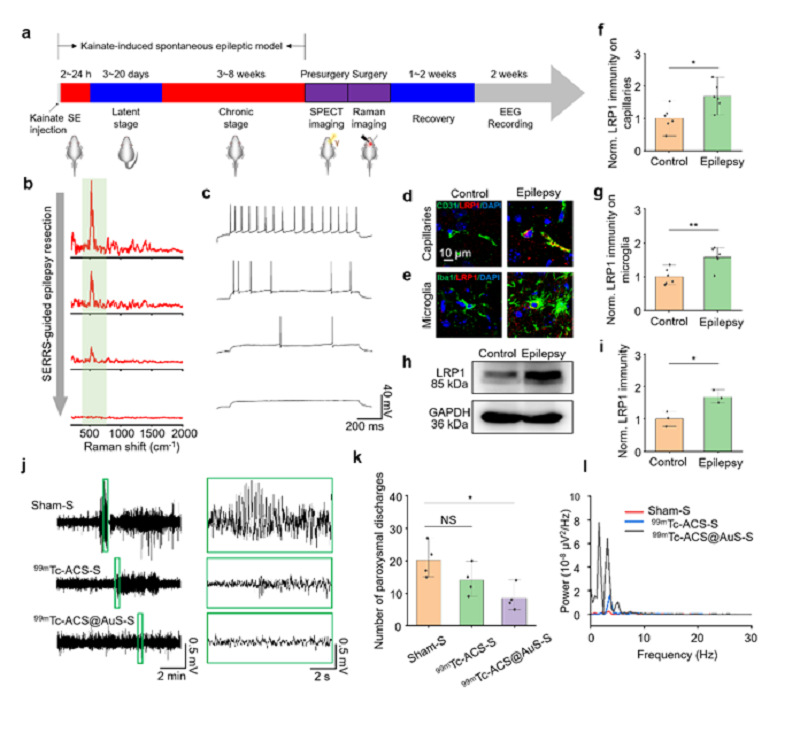
图7. 99mTc-ACS@AuS引导癫痫小鼠致痫灶切除。(a)实验流程图。(b)拉曼引导癫痫手术。99mTc-ACS@AuS的特征拉曼光谱标注为浅草绿色。(c)切除组织的膜片钳分析。(d和e)切除组织的血管内皮细胞(d)和小胶质细胞(e)的LRP1免疫荧光染色图像。(f和g)手术切除组织中血管内皮细胞(f)和小胶质细胞(g)LRP1免疫荧光强度半定量分析。(h)手术切除组织LRP1蛋白免疫印迹。(i)免疫印迹中LRP1表达水平半定量分析。(j)切除手术后癫痫小鼠的代表性脑电图。(k)癫痫手术后阵发性放电的次数。(l)癫痫手术后的脑电图功率谱。
本工作构建了一类基于SAM报告分子体系的LRP1靶向SPECT/SERRS双模态探针,该探针能够在术前通过SPECT无损、快速定位致痫灶位置,术中通过SERRS灵敏精准地引导致痫灶的切除。在动物水平验证了该手术策略能够显著改善预后。主要创新点在于:(1)揭示了通过靶向LRP1实现致痫灶定位的新思路,丰富了致痫灶定位的生物标志物;(2)提出了基于树枝状聚酰胺PAMAM构建SAM型拉曼报告分子的新策略,提高拉曼成像的灵敏度、稳定性及可定量性;(3)构建了SPECT/SERRS双模态癫痫成像探针,为克服术中脑漂移、实现致痫灶术前术中一体化定位导航提供了有效工具。
复旦大学附属华山医院硕士生李智、浙江大学医学院附属第二医院博士生孙琬冰、复旦大学药学院博士生段文佳为本文共同第一作者。复旦大学药学院李聪教授、复旦大学附属华山医院神经外科陈亮教授、复旦大学工程与应用技术研究院王聪博士后为本文共同通讯作者。该工作获得国家科技部重点研发项目,上海市科委计划项目,国家杰出青年科学基金,国家自然科学基金项目,上海市科技重大专项,国家博士后科研流动站创新人才培养计划,中国博士后科学基金项目和上海市科技项目的支持。
原文链接:http://doi.org/10.1021/acsami.2c02540.