脑电图是定位致痫灶的金标准,其通过监测异常神经元放电定位致痫灶。然而,颅内脑电存在空间分辨率低、观察区域有限、费用高昂等缺点。此外,深部脑电极插入不可避免地造成脑组织创伤。作为临床最主要的影像技术,磁共振成像(MRI)通过组织结构异常发现致痫灶,并具有无创、无检测深度限制、分辨率高等优势。然而,约30%难治性癫痫患者在MR图像上未表现结构异常,导致致痫灶定位困难。全世界范围内,仅有不到1%的癫痫患者最终实现了手术治疗。因此,开发高特异性、高信噪比的磁共振探针是定位“隐匿型”致痫灶的临床迫切需求。
2020年12月18日,复旦大学药学院李聪教授联合复旦大学附属华山医院神经外科陈亮教授,中国医药工业研究院王浩研究员在柳叶刀子刊EBioMedicine杂志上发表了题为:“Imaging epileptic foci in mouse models via a low-density lipoprotein receptor-related protein-1 targeting strategy”(基于低密度脂蛋白受体相关蛋白-1可视化小鼠癫痫模型致痫灶)的论文。该工作发现了病人癫痫病灶血脑屏障相对完整性和低密度脂蛋白受体-1(LRP1)在病灶血管内皮细胞、星形胶质细胞及小胶质细胞上表达显著增高。由此构建了一类靶向LRP1的胶束型磁共振探针。在海人酸诱导的小鼠局灶性癫痫模型中,该探针能够首先通过LRP1介导转胞吞作用跨越血脑屏障进入病灶区域,进一步靶向病灶部位活化的胶质细胞,最终实现病灶部位的T1磁共振信号增强。
本工作首先收集了5位难治性癫痫病人病灶组织。术前磁共振图像显示有三位患者无明显异常病灶(图1)。免疫荧光染色结果显示癫痫病灶处血管内皮细胞间紧密连接蛋白(ZO-1)表达相对完整,且血管内皮细胞、活化星型胶质细胞以及小胶质细胞上LRP1表达较正常脑组织显著升高(图2)。
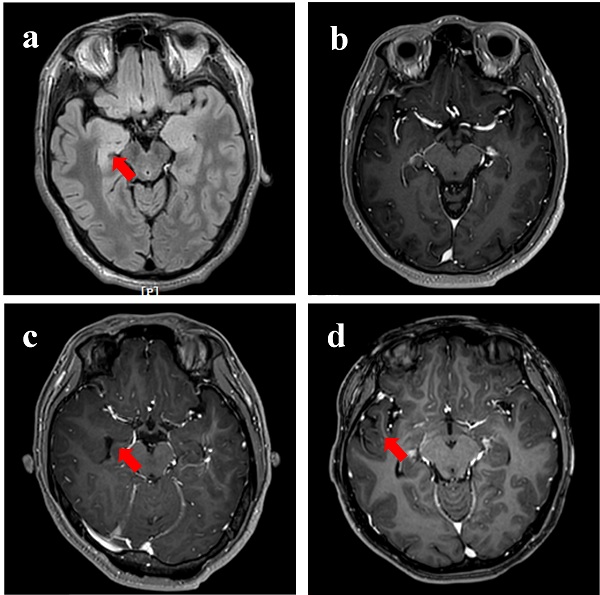
图1. 耐药性癫痫患者的代表性MR图像。(a)30岁男性,其右海马体中有高强度的T2信号。(b)32岁男性,给予Gd3+-DTPA后,T1W MR图像中无信号增强。(c)21岁女性,给以Gd3+-DTPA后,右海马无明显T1W信号增强。(d)25岁女性,给予Gd3+-DTPA后,右颞叶侧未检测到明显T1W信号增强。红色箭头指示切除癫痫灶。

图2. 难治性癫痫患者病灶中血脑屏障相对完整且LRP1表达上调。(a) 癫痫和正常脑组织紧密连接蛋白免疫荧光染色。血管内皮细胞(CD31),紧密连接蛋白-1(ZO-1);细胞核(DAPI)。(b) 癫痫和正常脑组织中血管内皮细胞LRP1的免疫荧光染色。(c) 癫痫组织中星形胶质细胞(GFAP)中LRP1表达水平。(d) 癫痫组织中小胶质细胞(Iba1)的LRP1表达水平。
基于此,该工作构建了一类具有胶束结构的T1磁共振探针(Gd3+-LP)。透射电镜显示该探针呈球形结构,粒径在10?15 nm,内核为疏水空腔,外壳标记有顺磁性基团。该探针水合粒径约在26 nm,表面电位为+8.2 mV。Gd3+-LP的r1弛豫率为11.8 mM-1s-1,远高于临床使用造影剂Gd3+-DTPA的弛豫率(3.9 mM-1s-1)(图3)。

图3. LRP1受体靶向磁共振探针Gd3+-LP的表征。(a)Gd3+-LP的构建。(b)Gd3+-LP(b)Gd3+-LP的透射电镜图像。比例尺 = 50 nm。(c)Gd3+-LP的水合粒径图。(d)不同浓度Gd3+-LP和Gd3+-DTPA溶液的T1加权成像及T1 map图。(e)Gd3+-LP和和Gd3+-DTPA的T1弛豫率(r1)。
通过海马原位注射海人酸构建了癫痫小鼠模型。采用免疫荧光染色考察不同时期LRP1表达水平与胶质细胞活化程度间的相关性(图4),癫痫小鼠急性期LRP1免疫荧光强度较假手术组明显升高(CA1区升高3.93 ± 1.0倍,P < 0.0001;CA3区上升3.97 ± 1.4倍,P < 0.0001;齿状回区升高3.75 ± 0.3倍,P < 0.0001),相比于急性期,LRP1表达在潜伏期有所下调,相较于急性期,CA1区降为0.62 ± 0.1倍(P = 0.02),CA3区降为0.60 ± 0.2倍(P = 0.03),齿状回下降为0.62 ± 0.1倍(P = 0.003);慢性期LRP1表达又有所上调,与急性期比,CA1区为0.92 ± 0.3倍(P = 0.9),CA3区为0.99 ± 0.2倍(P = 0.05),齿状回区为1.02 ± 0.3倍(P = 1.0)。
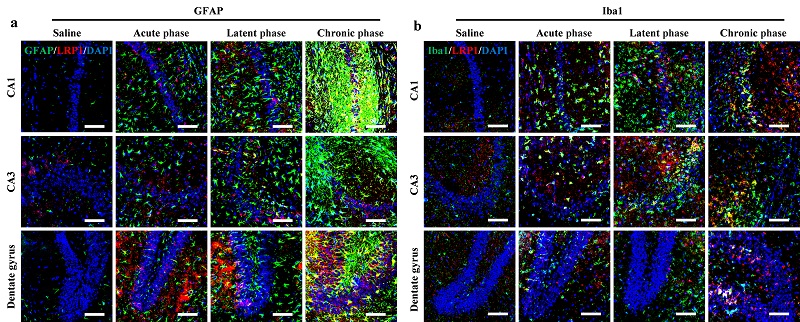
图4. KA癫痫小鼠模型中LRP1在活化胶质细胞中表达上调。(a)KA模型和假手术对照小鼠脑海马区星型胶质细胞LRP1免疫荧光染色图像。(b)KA模型和假手术对照小鼠脑海马区小胶质细胞LRP1免疫荧光染色图像。
活体磁共振成像研究了LRP1梯次靶向成像策略定位癫痫病灶可行性。将慢性期癫痫小鼠模型随机分为三组(n = 3),分别尾静脉给予钆剂量相同(0.1 mmol/kg)的LRP1靶向探针Gd3+-LP、非靶探针Gd3+-CP以及临床小分子T1造影剂Gd3+-DTPA。另加一组假手术组,注射Gd3+-LP。如图5所示,注射Gd3+-LP后90分钟,在同侧海马中观察到明显的T1W磁共振信号增强,定量结果显示,注射无LRP1靶向性的对照探针(1.07 ± 0.02 vs 1.11 ± 0.02 for Gd3+-LP, P < 0.05)或假手术组(1.02 ± 0.02 for vs 1.11 ± 0.02 for Gd3+-LP, P < 0.001)后,病灶部位MR信号增强明显降低。

图5. Gd3+-LP定位慢性癫痫小鼠模型病灶。(a)在癫痫模型小鼠或假手术小鼠中,尾静脉注射具有相同Gd3+浓度(0.1 mmol/kg)的Gd3+-LP,Gd3+-CP,Gd3+-DTPA或假手术组之前及之后相应时间点的冠状位MR图像。箭头指向癫痫病灶。(b)同侧海马中的T1W MR信号强度值随时间的变化。
该工作报道了一类LRP1靶向T1加权磁共振造影剂,其通过梯次跨血脑屏障及炎性胶质细胞靶向策略,有望实现“隐匿性”癫痫病灶的无创定位,为扩大难治型癫痫患者人群手术治疗机会提供了新技术。该工作还具有以下三点意义:1. 发现了癫痫病人病灶区域血脑屏障相对完整性,揭示了致痫灶成像及递药过程中跨血脑屏障的必要性;2. 发现了LRP1受体在癫痫病灶多种细胞中表达上调;3. 提出了基于LRP1受体的梯次成像致痫灶定位策略,为提高致痫灶定位准确性提供新技术。
该项目得到了国家自然科学基金(项目编号:81771895)、 国家杰出青年科学基金(项目编号:82025019)、上海市“脑与类脑智能基础转化应用研究”市级科技重大专项(项目编号:2018SHZDZX01)等项目的资助。复旦大学药学院李聪教授、中国医药工业研究院王浩研究员以及复旦大学附属华山医院神经外科陈亮教授为本文的共同通讯作者。复旦大学药学院博士生王聪、复旦大学附属肿瘤医院的张建平主管技师为共同第一作者。研究团队还得到了复旦大学附属肿瘤医院宋少莉教授和复旦大学附属华山医院神经外科毛颖教授的帮助。
论文链接:https://www.sciencedirect.com/science/article/pii/S2352396420305326?via%3Dihub
Abstract: Background: In the setting of drug-resistant epilepsy (DRE), the success of surgery depends on the ability to accurately locate the epileptic foci to be resected or disconnected. However, the epileptic foci in a considerable percentage of the DRE patients cannot be adequately localised. This warrants the need for a reliable imaging strategy to identify the “concealed” epileptic regions. Methods: Brain specimens from DRE patients and kainate-induced epileptic mouse models were immunostained to evaluate the integrity of the blood-brain barrier (BBB). The expression of low-density lipoprotein receptor-related protein-1 (LRP1) in the epileptic region of DRE patients and kainate models was studied by immunofluorescence. A micellar-based LRP1-targeted paramagnetic probe (Gd3+-LP) was developed and its ability to define the epileptic foci was investigated by magnetic resonance imaging (MRI). Findings: The integrity of the BBB in the epileptic region of DRE patients and kainate mouse models were demonstrated. LRP1 expression levels in the epileptic foci of DRE patients and kainate models were 1.702.38 and 2.323.97 folds higher than in the control brain tissues, respectively. In vivo MRI demonstrated that Gd3+-LP offered 1.68 times higher (P < 0.05) T1-weighted intensity enhancement in the ipsilateral hippocampus of chronic kainite models than the control probe without LRP1 specificity. Interpretation: The expression of LRP1 is up-regulated in vascular endothelium, activated glia in both DRE patients and kainate models. LRP1-targeted imaging strategy may provide an alternative strategy to define the “concealed” epileptic foci by overcoming the intact BBB.