脑胶质瘤占所有颅内原位恶性肿瘤发病率70%,具有发病率、复发率、死亡率高和治愈率低等特点。胶质瘤的有效治疗是世界公认的难题。在已批准用于癌症治疗的众多化疗药物中,仅有极少数对胶质瘤有效。胶质瘤浸润区域血脑屏障相对完整导致药物难以有效瘤内递送是化疗效果差的重要原因。近日,复旦大学李聪教授课题组在《Theranostics》杂志上(IF 8.712)发表论文,发现了不同恶性级别胶质瘤病人肿瘤浸润区域均存在完整的血脑屏障结构,证实了调控血脑屏障通透性提高药物递送疗效的必要性。该工作利用无创影像学动态监测胶质瘤浸润区域通透性,当肿瘤浸润区域与正常脑组织血管通透性比值达到最大时注射药物,在提高靶向递送效率同时降低毒副作用。
血脑屏障是脑组织毛细血管的一种特殊生理结构,在维持大脑生理功能和稳态过程中发挥重要作用。由于其低通透性,大约98%的小分子及绝大多数的大分子药物难以跨越血脑屏障入脑。血脑屏障的结构和功能在脑胶质瘤发展过程中也伴随着动态演变。尽管胶质瘤核心区域血脑屏障结构破坏明显,但其浸润区则基本保持完整,这也是导致该区域难以示踪、难以递药、易于复发等关键原因。李聪教授课题组构建了一类腺苷2A受体(A2AR)纳米激动剂,其首先靶向胶质瘤浸润区域的新生血管,通过特异性激活A2AR信号通路促使血管内皮细胞骨架收缩,开启内皮细胞间紧密连接,暂时性提高血脑屏障通透性。当无创影像技术发现胶质瘤浸润区域和与周围正常脑组织通透性比值达到最大时,注射化疗药物紫杉醇,在提高药物疗效同时降低其对正常组织的毒副作用。
血脑屏障阻止药物入脑并发挥疗效是几乎所有中枢神经系统疾病治疗面临的共同难题。基于腺苷受体激动剂的血脑屏障靶向调控技术和影像指导下的递药策略可以拓展到包括脑血管疾病、神经退行性疾病和精神类疾病等其他中枢神经系统疾病的治疗,具有重要的科学和临床意义。
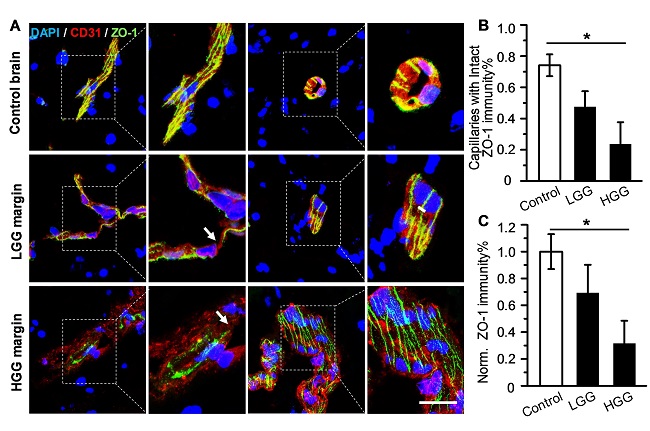
图1.不同恶性疾病胶质瘤患者肿瘤浸润边缘血脑屏障局部完整。(A)对照脑组织、低级别和高级别胶质瘤边缘部位的血管内皮细胞和ZO-1蛋白的免疫荧光染色图像。CD31抗体标记发的血管内皮细胞显示为红色,ZO-1蛋白为绿色;DAPI染色的细胞核显示为蓝色。比例尺:30 μm。(B)对照脑组织和胶质瘤边缘组织中,具有完整紧密连接蛋白的毛细血管所占百分比。(C)对照脑组织和胶质瘤边缘血管ZO-1蛋白的免疫荧光强度。LGG:低级别胶质瘤;HGG:高级别胶质瘤。
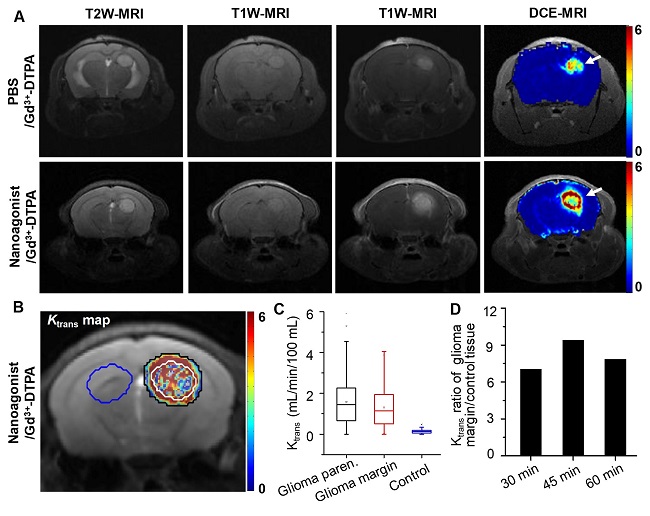
图2. 纳米激动剂增加胶质瘤浸润边缘血脑屏障通透性。(A)胶质瘤原位移植裸鼠使用Gd3+-DTPA(上排)处理或Den-RGD-Reg和Gd3+-DTPA联合(下排)处理后的T2W-MR、T1W-MR和DCE-MR图像。(B)Den-RGD-Reg处理后小鼠脑部的Ktrans图。注射纳米激动剂45 min后再注射Gd3+-DTPA,白线圈出区域为肿瘤实质部分,白线圈和黑线圈之间为肿瘤边缘,蓝线圈出区域为对照脑组织。(C)注射纳米激动剂后,胶质瘤实质、胶质瘤边缘和对照脑组织的平均Ktrans值。(D)注射纳米激动剂30 min、45 min、60 min后在胶质瘤边缘和对照脑组织间的Ktrans比值。

图3. 纳米激动剂增加胶质瘤对模型药物的摄取。(A)静脉注射99mTc-DTPA后小鼠脑部的活体SPECT/CT成像(上排)。Den-PEG和99mTc-DTPA联合给药(组1)、Den-Reg和99mTc-DTPA联合给药(组2)以及Den-RGD-Reg和99mTc-DTPA联合给药(组3)的小鼠脑部的体内SPECT/CT成像(下排)。99mTc-DTPA为模型药物,在注射纳米激动剂45 min后注射。(B)注射Den-PEG、Den-Reg或Den-RGD-Reg 45min后,注射99mTc-DTPA (3.7 ×106 Bq/鼠),胶质瘤与正常脑组织的%ID/g比值。(C)注射99mTc-DTPA 90 min后,裸鼠脑部切片的放射自显影图像,箭头指胶质瘤组织。(D)放射性自显影图像中正常脑组织和胶质瘤区域中99mTc-DTPA的相对放射性强度。
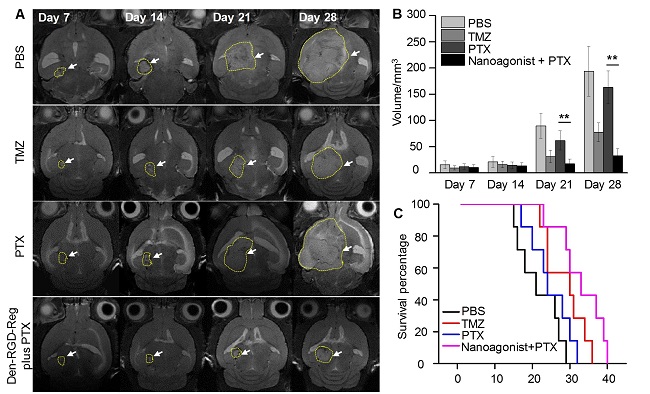
图4. 影像引导的血脑屏障通透性调控和药物递送策略提高胶质瘤化疗效果。(A)使用PBS、TMZ、PTX、纳米激动剂和PTX联合治疗后,荷胶质瘤裸鼠脑部活体T2W-MR图像。各治疗组荷胶质瘤裸鼠的肿瘤大小(B)和存活率(C)随时间变化。PTX:紫杉醇,TMZ:替莫唑胺。
复旦大学药学院博士研究生高西辉和复旦大学附属华山医院岳琪博士为论文的并列第一作者,复旦大学药学院李聪教授和复旦大学附属华山医院陈亮教授为论文的并列通讯作者。中科院武汉物理与数学研究所波谱与原子分子物理国家重点实验室周欣研究员在磁共振成像技术方面给予了支持。该研究获得国家自然科学基金委和上海市科委重点项目的支持。
参考文献:
Xihui Gao, Qi Yue, Yikang Liu, Dandan Fan, Kun Fan, Sihan Li, Jun Qian, Limei Han, Fang Fang, Fulin Xu, Daoying Geng, Liang Chen, Xin Zhou, Ying Mao and Cong Li. Image-guided chemotherapy with specifically tuned blood brain barrier permeability in glioma margins. Theranostics 2018; 8(11): 3126-3137.
原文链接: http://www.thno.org/v08p3126.htm
DOI: 10.7150/thno.24784
Abstract: Blood–brain barrier (BBB) disruption is frequently observed in the glioma region. However, the tumor uptake of drugs is still too low to meet the threshold of therapeutic purpose. A tumor vasculature-targeted nanoagonist was developed. Glioma targeting specificity of the nanoagonist was evaluated by in vivo optical imaging. BBB permeability at the glioma margin was quantitatively measured by dynamic contrast enhanced magnetic resonance imaging (DCE-MRI). Single-photon emission computed tomography imaging/computed tomography (SPECT/CT) quantitatively determined the glioma uptake of the radiolabeled model drug. T2-weighted MRI monitored the tumor volume. Immunostaining studies demonstrated that the BBB remained partially intact in the invasive margin of patients’ gliomas regardless of their malignancies. DCE-MRI showed that vascular permeability in the glioma margin reached its maximum at 45 min post nanoagonist administration. In vivo optical imaging indicated the high glioma targeting specificity of the nanoagonist. SPECT/CT showed the significantly enhanced glioma uptake of the model drug after pre-treatment with the nanoagonist. Image-guided paclitaxel injection after nanoagonist-mediated BBB modulation more efficiently attenuated tumor growth and extended survival than in animal models treated with paclitaxel or temozolomide alone. Thus, image-guided drug delivery following BBB permeability modulation holds promise to enhance the efficacy of chemotherapeutics to glioma