线粒体作为细胞的“能量工厂”,在维持细胞能量稳态、氧化应激等方面发挥重要作用。由于大脑高能耗需求,神经元线粒体数量往往是外周体细胞的几十至数百倍。线粒体自噬是细胞选择性清除受损线粒体、维持线粒体群体健康和能量稳态的关键事件。线粒体自噬包括受损线粒体被自噬小体包裹并最终运送到溶酶体降解等步骤,通常涉及三种类型线粒体自噬中间体:线粒体、线粒体自噬体和线粒体溶酶体。线粒体自噬中间体数量比例变化和空间分布特征不仅与神经元能量稳态维持、氧化应激损伤保护密切相关,在神经退行性疾病进展过程中也发挥重要作用。
在阿尔茨海默症(AD)发展过程中,线粒体自噬水平降低不但与线粒体损伤、细胞能量供应短缺、毒蛋白沉积等事件密切相关,还往往早于认知障碍等典型症状出现。研究表明,线粒体自噬诱导药物能够降低AD淀粉样蛋白和Tau蛋白病理沉积,增强小胶质细胞吞噬功能,缓解AD相关认知障碍。因此,可视化活细胞内线粒体自噬水平及其关键中间过程体对于了解AD发病机制和药物筛选具有重要意义。首先,线粒体自噬功能障碍通常源于其关键中间过程受阻;其次,不同药物对线粒体自噬中间体的影响各不相同。因此,可视化胞内线粒体自噬中间体的数量比例和空间分布,有助于全面评估线粒体自噬进程,提高线粒体自噬诱导剂筛选效率。
目前,超分辨荧光显微镜成像技术虽能观测活细胞线粒体自噬水平,但仍存在多重荧光染色操作复杂、光谱重叠干扰信号解析,以及潜在细胞毒性等问题,难以同步、精准地识别关键自噬中间体,也无法定量研究自噬损伤的具体步骤。因此,实现活细胞线粒体自噬中间体的连续、同步、定量可视化是该领域亟待解决的问题。
近日,复旦大学药学院李聪教授、游艳青年研究员,复旦大学信息科学与工程学院余锦华教授,及云南大学药学院雷祖海教授联合研究团队在Nature Communications(自然-通讯)杂志发表了题为:“An AI-assisted fluorescence microscopic system for screening mitophagy inducers by simultaneous analysis of mitophagic intermediates”(人工智能驱动荧光显微成像系统可视化线粒体自噬中间体筛选线粒体自噬诱导剂)的研究论文。该工作开发了一种AI辅助荧光显微成像系统(AI-FM),用于活细胞线粒体自噬流的实时、动态、定量评估(图1)。AI-FM系统将具有线粒体靶向性的pH比率响应荧光探针Mcy3与深度学习模型有机结合,实现线粒体自噬中关键中间体的准确识别,并提供胞内各类中间体分布、密度、比例等定量信息,平均检测准确率高达86%。研究人员利用AI-FM系统筛选出一种新型线粒体自噬诱导剂Y040-7904。该化合物能够促进受损线粒体向自噬小体转运,并提高神经元线粒体自噬水平。在AD神经元细胞模型和AD线虫模型中,Y040-7904通过激活SIRT1/FoxO3信号通路,有效改善Aβ病理,展现出对AD潜在疗效。这项研究不仅为活细胞线粒体自噬的精准评估提供了新工具,也为神经退行性疾病的机制研究和药物筛选开辟了新路径。
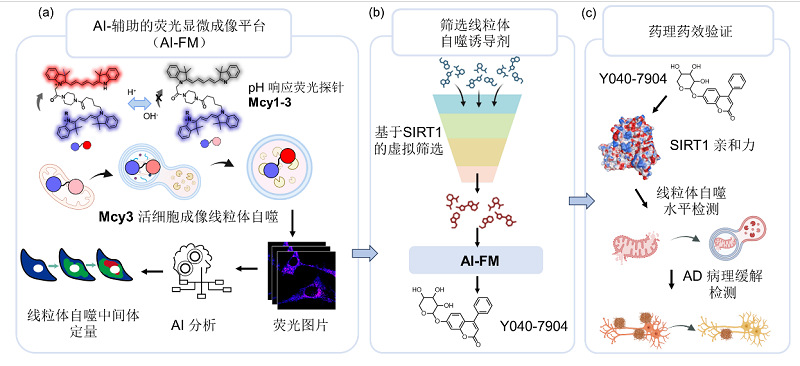
图1. AI辅助线粒体自噬荧光成像平台的构建,线粒体自噬诱导剂筛选和药效评价的流程。
在这项工作中,团队首先开发了一系列线粒体靶向的pH响应探针Mcy1–3,并阐明了其pH响应机制和光学性质。进一步,三种探针的表征实验表明Mcy3具有最好的线粒体靶向能力和良好的光物理性质,因此选用其做后续实验的目的探针。
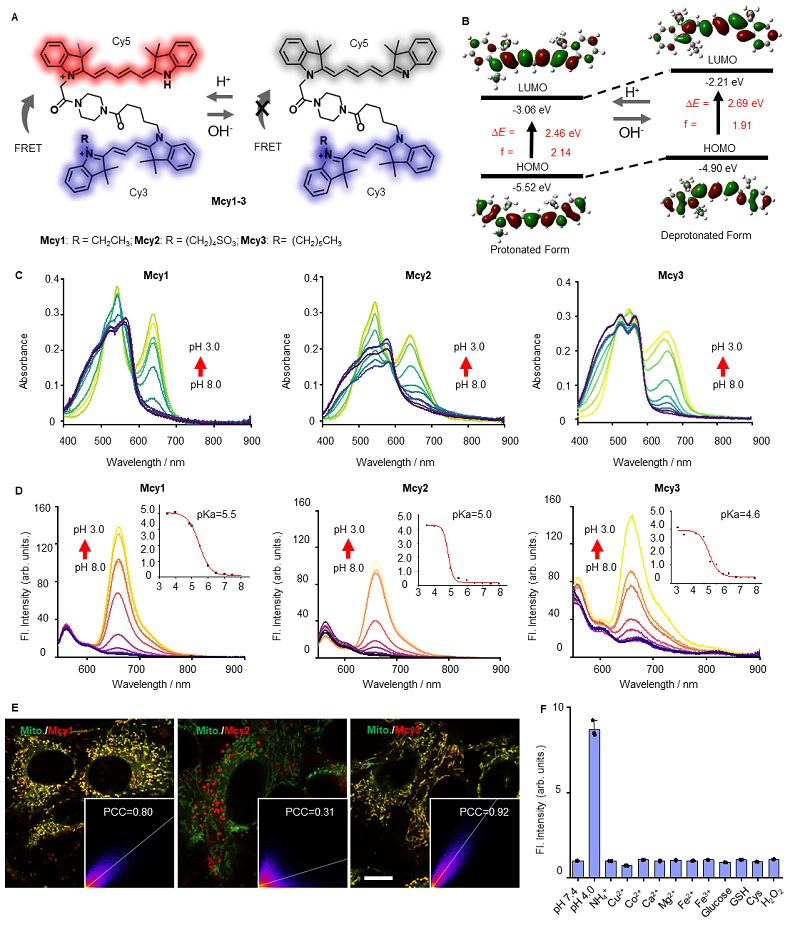
图2. 可视化线粒体自噬过程的pH比率响应荧光探针的开发。(A) pH响应型荧光探针Mcy1至Mcy3在质子化和去质子化形式下的化学结构。(B) 不对称Cy5在在B3LYP/6–311 G(d,p)水平下的含时密度泛函理论(TDDFT)计算。(C)Mcy1–Mcy3(1×10⁻⁵ M)的吸收光谱。(D) Mcy1–Mcy3(1×10⁻⁵ M)的荧光光谱。(E)Mitotracker Green(1.0 μM)和Mcy1、Mcy2或Mcy3(2.0 μM)共同孵育的小鼠海马神经元细胞系(HT22细胞)的共聚焦荧光图像。PCC:皮尔逊共定位相关系数。Mitotracker Green:激发波长(Ex)=488 nm,发射波长(Em)=500‒530 nm。Mcy1–Mcy3:激发波长(Ex)=561 nm,发射波长(Em)=580‒700 nm。比例尺=10微米。(F) 经生理状况下金属离子和氨基酸处理后Mcy3(5 μM)的荧光强度。铵离子(NH₄⁺)、铜离子(Cu²⁺)、钴离子(Co²⁺)、钙离子(Ca²⁺)、镁离子(Mg²⁺)、亚铁离子(Fe²⁺)、铁离子(Fe³⁺)、过氧化氢(H₂O₂),浓度为200 μM;葡萄糖、谷胱甘肽和半胱氨酸,浓度为5 mM,数据以平均值±标准差表示。样本数量n=3。
接下来,Mcy3探针实现了对活细胞线粒体自噬过程的可视化。利用Mcy3监测了羰基氰化物间氯苯腙(CCCP)诱导的线粒体自噬过程中线粒体pH值的变化及其转移过程。为了更深入地研究线粒体自噬中间体的动态变化,团队对线粒体自噬体(Mcy3与GFP-LC3共定位)和线粒体溶酶体(Mcy3与Lysotracker共定位)的数量和线粒体自噬通量(Mitophagy flux)进行了量化。该部分内容证明Mcy3对线粒体自噬过程可视化的可行性和动态监测能力。
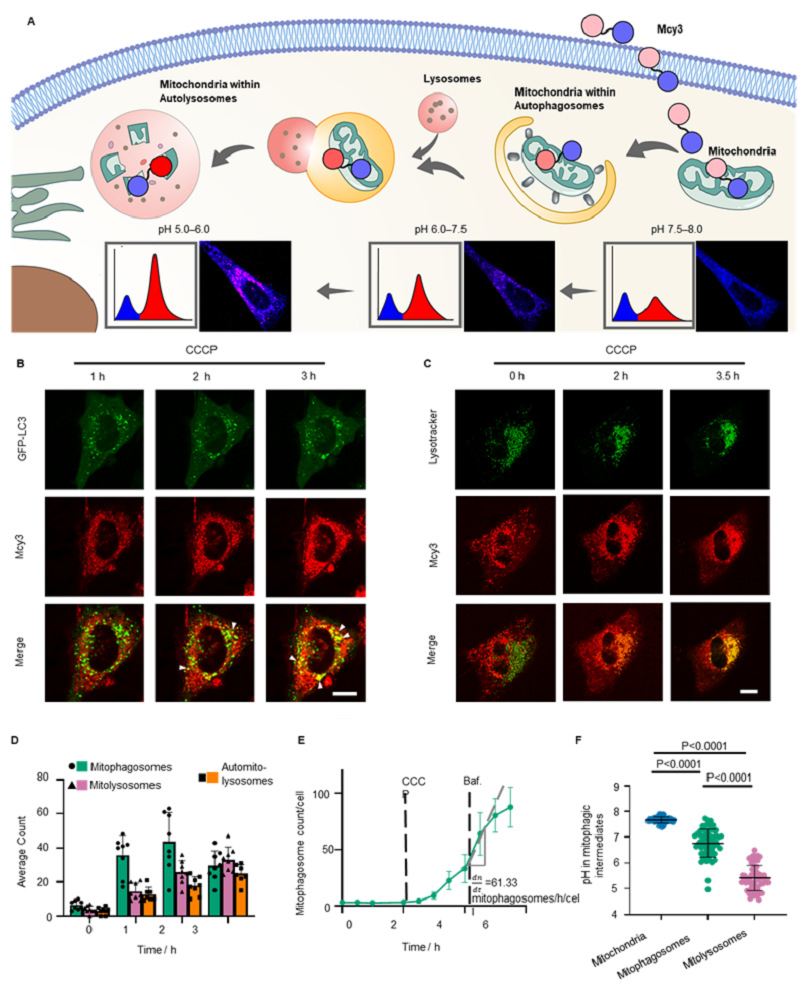
图3. Mcy3探针在活细胞内动态可视化线粒体自噬过程。(A) Mcy3通过测定细胞内pH值来监测线粒体自噬示意图。(B)线粒体与自噬体融合的代表性共聚焦图像。GFP-LC3激发波长(Ex):488 nm,发射波长(Em):500‒530 nm。Mcy3激发波长(Ex):561 nm,发射波长(Em):580‒700 nm。比例尺=10微米。(C)线粒体与自噬溶酶体的融合的代表性共聚焦图像。Lysotracker激发波长(Ex):405 nm,发射波长(Em):415‒430 nm。Mcy3激发波长(Ex):561 nm,发射波长(Em):580‒700 nm。比例尺=10微米。(D)在羰基氰化物间氯苯腙(CCCP)诱导后每个细胞中平均的线粒体自噬体、线粒体溶酶体和线粒体自噬溶酶体的数量。细胞数量n=9。数据以平均值±标准差表示。(E)经CCCP处理2小时以及100 nM巴佛洛霉素A1处理2小时后的线粒体自噬体数量。数据以平均值±标准差表示。(F)线粒体、线粒体自噬体和线粒体溶酶体的pH值。数据以平均值±标准差表示。
随后双分支多尺度注意力残差网络(DMAN)被应用于处理Mcy3染色的细胞显微图像。DMAN基于残差网络(ResNet)与卷积块注意力模块(CBAM)构建。在DMAN的训练阶段,采用多尺度方法提取线粒体的细粒度荧光强度特征与粗粒度形态特征。在DMAN的推理阶段,对荧光图像中的细胞器进行分类,实现线粒体自噬中间体的像素级别分类。该模型的优势如下:(1)同时捕捉线粒体的形态和pH两种指标,检测准确度比单指标提高12%。(2)在测试阶段提出滑窗策略,实现线粒体自噬中间体的像素级别分类,提高分辨率。(3)实现利用单一荧光染料准确识别关键中间体,并提供胞内各类中间体分布、密度、比例等定量信息。突破传统主观评估不准确性和繁杂性。
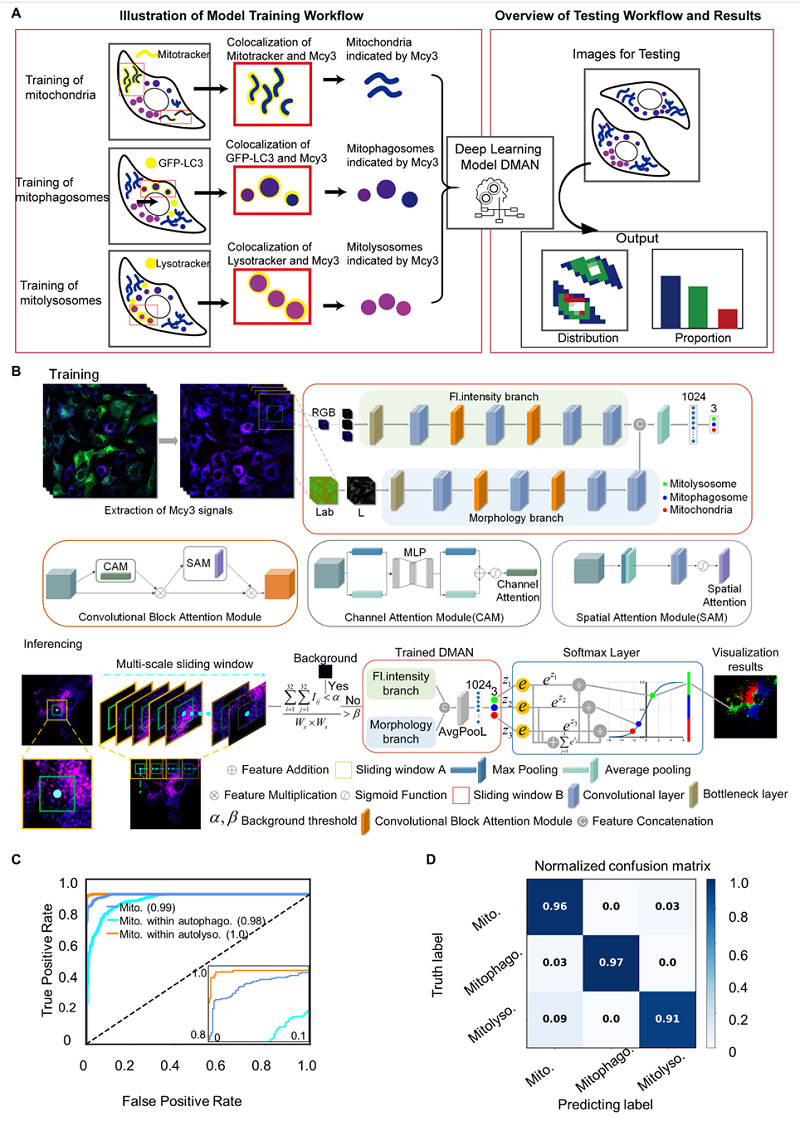
图4. 深度学习模型DMAN的工作原理及模型表现。(A)深度学习模型DMAN的工作流程示意图。(B)双分支多尺度注意力残差网络(DMAN)模型示意图。DMAN基于残差网络(ResNet)与卷积块注意力模块(CBAM)构建。在训练阶段,DMAN采用多尺度方法提取细粒度荧光强度特征与粗粒度形态特征。对于荧光强度特征,32×32像素的图像块被分解为三个RGB通道;对于形态特征,则使用128×128像素图像块的单一亮度通道。在推理阶段,采用滑窗方法遍历荧光图像中的每个像素,每个像素的分类由以该像素为中心的大窗口和小窗口的注意力分数共同决定。(C)十倍交叉验证中的ROC曲线(Receiver Operating Characteristic,受试者工作特征曲线)与AUC值(Area Under the Curve,曲线下面积)。(D)十倍交叉验证中模型对三类样本预测的混淆矩阵。
荧光探针Mcy3与深度学习模型DMAN的结合构建了人工智能辅助的荧光显微成像系统(AI-FM)用于活细胞线粒体自噬流的智能化实时、动态、精准评估。AI-FM评估线粒体自噬中间体的准确性被进一步验证达到80%以上。团队将AI-FM用于检测不同线粒体自噬诱导和抑制药物对活细胞的作用,结果表明,在不同线粒体自噬诱导剂(CCCP, DFP)和不同条件(线粒体自噬诱导、线粒体自噬抑制)下,AI-FM均有良好的表现,揭示了其评估线粒体自噬药物的潜力。
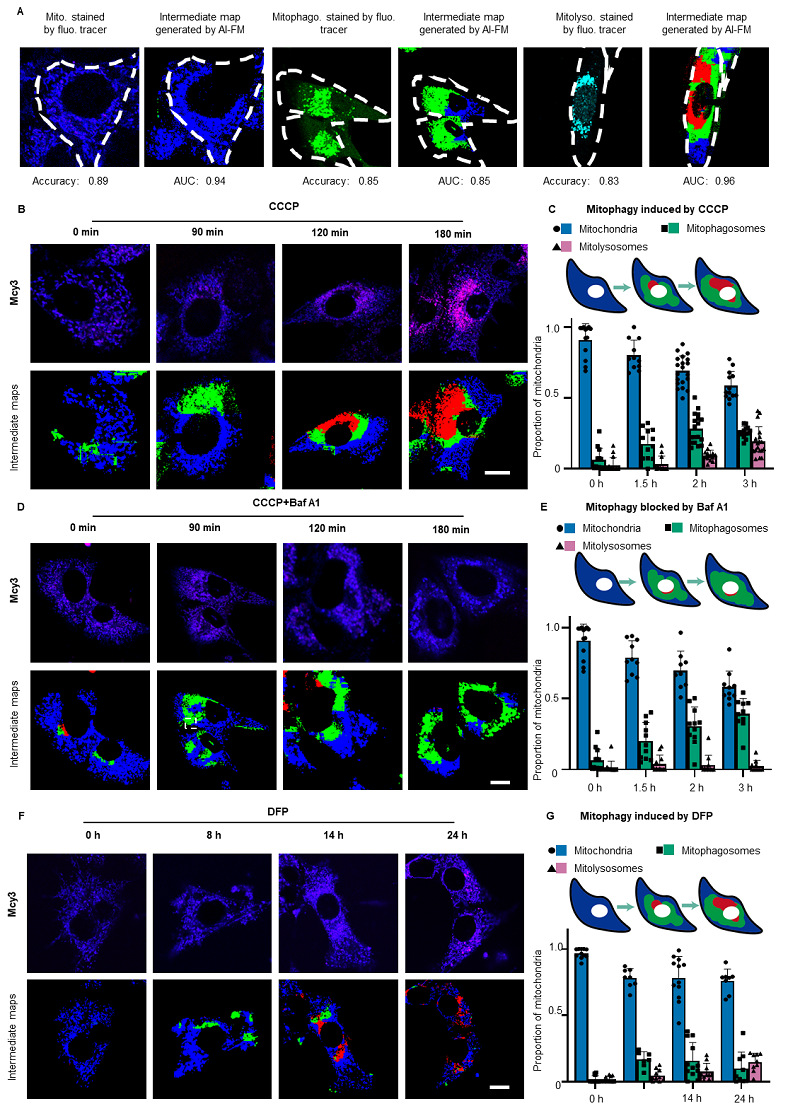
图5. AI-FM系统在活细胞内定量检测线粒体自噬中间体。(A)荧光标志物对照的三类线粒体自噬中间体荧光图像(左图)及DMAN模型生成的伪彩色中间产物分布图(右图)的对比。在中间体布图中,蓝色区域表示线粒体,绿色区域表示线粒体自噬体红色区域表示线粒体溶酶体(。图像下方展示了模型在测试集上对三类线粒体自噬中间产物的平均ACC和AUC值。(B)上图:HT22细胞经Mcy3(2.0 μM)预处理后,暴露于线粒体自噬诱导剂CCCP 0、60、120和180分钟的共聚焦荧光图像。蓝色通道:Ex=561 nm, Em=580‒600 nm。红色通道:Ex=561 nm, Em=600‒700 nm。比例尺=10 μm。下图:DMAN模型生成的中间体分布图。预测的线粒体、线粒体自噬体和线粒体溶酶体分别以蓝色、绿色和红色显示。(C)CCCP处理后不同时间点的线粒体、线粒体自噬体和线粒体溶酶体的组成比例。每组n=15个细胞。(D)上图:HT22细胞经Mcy3预处理后,与CCCP和Baf A1(100 nM)共孵育0、60、120和180分钟的代表性荧光图像。蓝色通道:Ex=561 nm, Em=580‒600 nm。红色通道:Ex=561 nm, Em=600‒700 nm。比例尺=10 μm。下图:DMAN模型生成的中间体分布图。(E)CCCP+Baf A1处理后不同时间点的线粒体、线粒体自噬体和线粒体溶酶体的组成比例。每组n=15个细胞。(F)上图:HT22细胞经Mcy3(2.0 μM)预处理后,暴露于线粒体自噬诱导剂DFP 0、8、14和24分钟的共聚焦荧光图像。蓝色通道:Ex=561 nm, Em=580‒600 nm。红色通道:Ex=561 nm, Em=600‒700 nm。比例尺=10 μm。下图:DMAN模型生成的中间体分布图。预测的线粒体、线粒体自噬体和线粒体溶酶体分别以蓝色、绿色和红色显示。(G)DFP处理后不同时间点的线粒体、线粒体自噬体和线粒体溶酶体的组成比例。每组n=11个细胞。
建立AI-FM系统后,团队进一步将其应用于筛选潜在的线粒体自噬诱导剂。首先通过SIRT1为靶点的虚拟筛选筛选出19种候选化合物,随后通过AI-FM评估筛选出的化合物的有效性。最终获得了一种具有潜在线粒体自噬诱导效果的SIRT1激动剂Y040-7904。
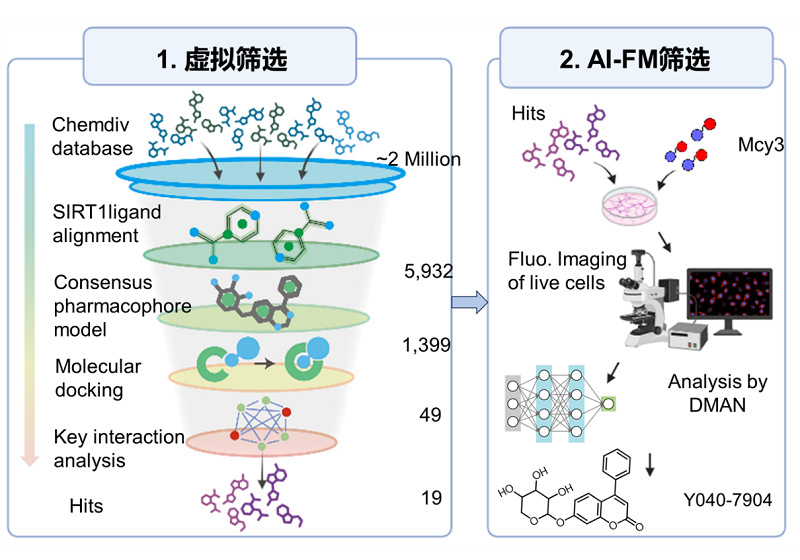
图6. 线粒体自噬诱导剂筛选流程示意图。步骤1:SIRT1激动剂的虚拟筛选模型。通过对两百万种化合物库进行筛选,鉴定出19种先导化合物。步骤2:利用AI-FM对19种先导化合物进行评估。最终筛选出Y040-7904为线粒体自噬诱导剂。
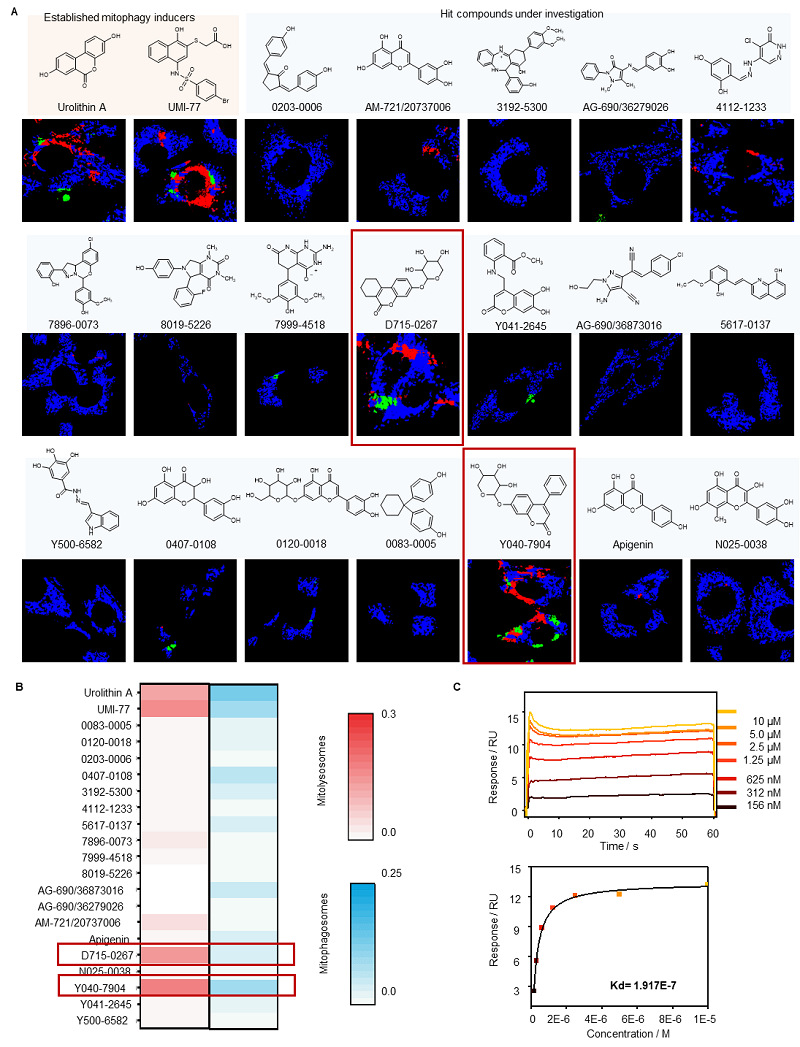
图7. AI-FM筛选线粒体自噬诱导剂Y040-7904。(A)两种已知线粒体自噬诱导剂及19种待测候选化合物化学结构,及其在HT22细胞中诱导线粒体自噬中间体的伪彩分布图。蓝色:线粒体;绿色:线粒体自噬体;红色:线粒体溶酶体。(B)经线粒体自噬诱导剂或候选化合物处理后,经AI-FM分析的HT22细胞中线粒体自噬中间体的比例。(C)表面等离子共振(SPR)计算的Y040-7904与Sirt1蛋白结合的浓度依赖性曲线图。
接下来,Y040-7904的促线粒体自噬作用被进一步研究,主要包括药效研究和机制研究两方面。上结果表明Y040-7904依赖SIRT1-FoxO3促进线粒体自噬相关蛋白PINK1和Parkin的表达,最终导致线粒体自噬水平的升高。
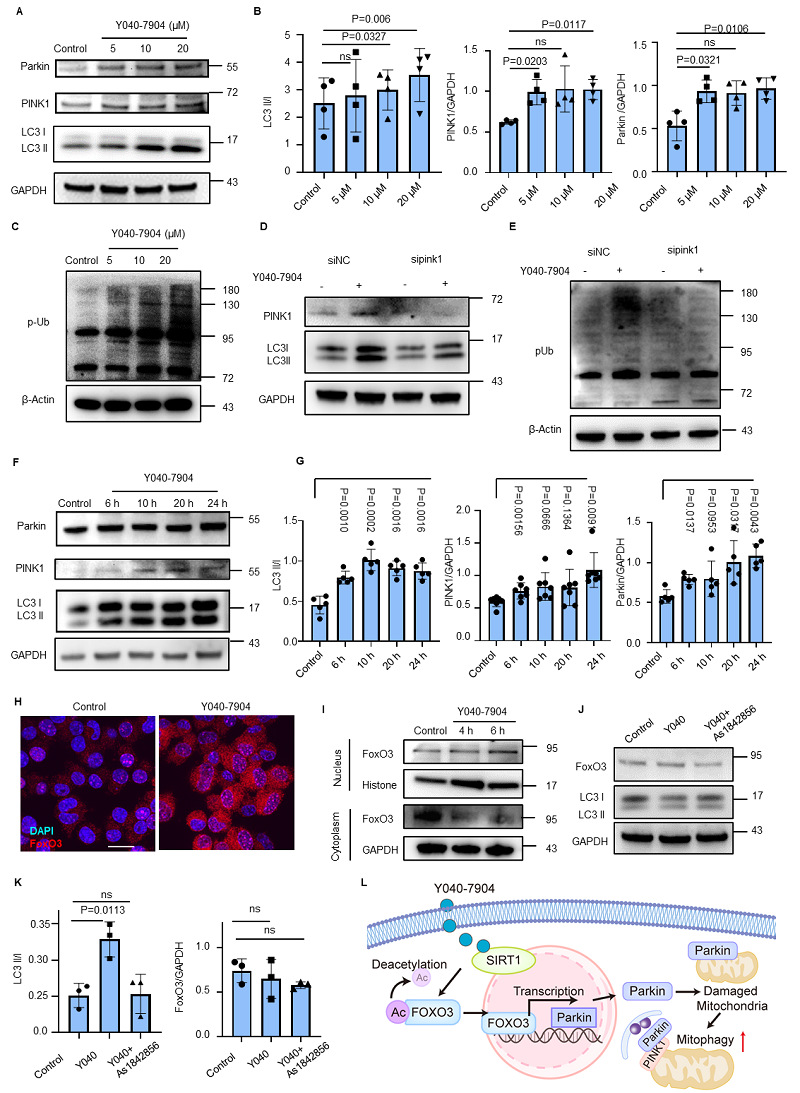
图8. Y040-7904通过SIRT1/FoxO3通路提高线粒体自噬。(A)不同浓度(5–20 μM)Y040-7904处理细胞24小时后,线粒体自噬相关蛋白水平的免疫印迹分析。(B) 使用Image J对(A)中线粒体自噬相关蛋白进行定量分析。统计学显著性通过双尾配对t检验确定。(C)不同浓度(5–20 μM)Y040-7904处理细胞24小时后,磷酸化泛素(pUb)水平的免疫印迹分析。(D)使用Image J对(C)中的结果进行定量分析。统计学显著性通过单因素方差分析(ANOVA)确定。(E)在si-NC和si-PINK1转染的HT22细胞中,Y040-7904处理后pUb、LC3II/I和PINK1水平的免疫印迹分析。(F) Y040-7904(20 μM)处理不同时间(6 h、10 h、20 h和24 h)后,线粒体自噬相关蛋白水平的免疫印迹分析。(G)对(F)中Y040-7904处理后的线粒体自噬相关蛋白进行定量分析。统计学显著性通过双尾配对t检验确定。(H)对照组和Y040-7904(20 μM)处理的HT22细胞中FoxO3的免疫荧光图像。(I) Y040-7904作用不同时间的细胞核和细胞质FoxO3水平的蛋白免疫印迹。(J)经Y040-7904或FoxO3抑制剂AS1842856处理的HT22细胞中FoxO3和LC3的表达水平。(K)对(A)中所示蛋白的定量分析。统计学显著性通过单因素方差分析(One-way ANOVA)结合Dunnett多重比较检验进行判定。(L) Y040-7904诱导线粒体自噬的机制的示意图。
由于线粒体自噬在AD病理中起到的重要调控作用,因此团队进一步验证了Y040-7904对AD的潜在治疗效果。在AD的细胞模型和秀丽隐杆线虫模型中,Y040-7904均表现出来缓解Aβ病理的作用。
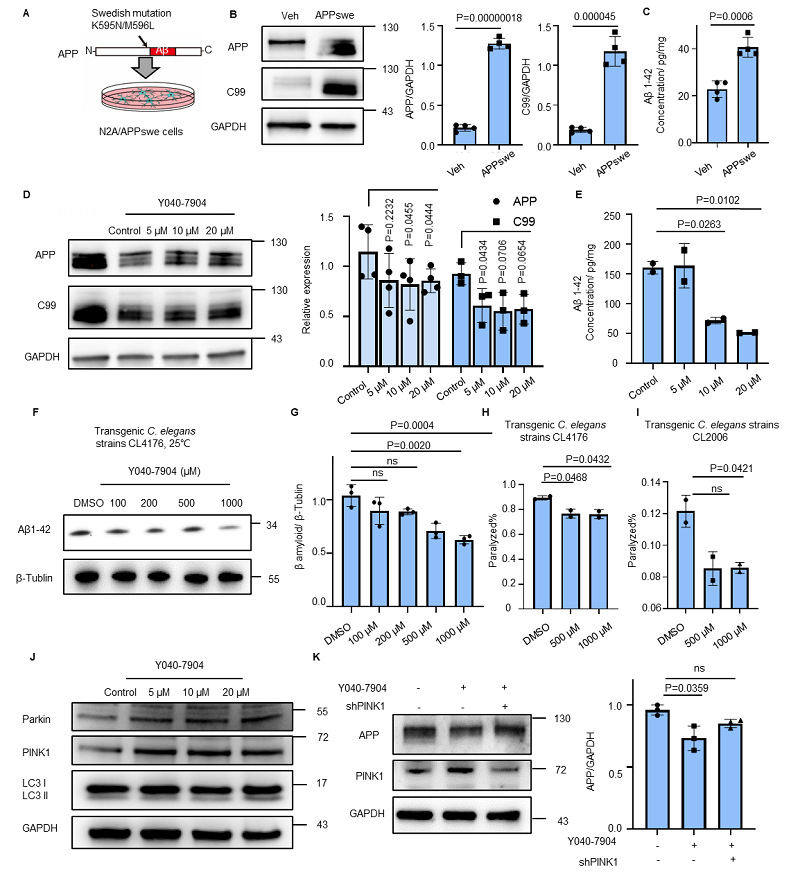
图9. Y040-7904在AD神经元细胞及线虫模型缓解AD病理。(A) N2a/APPswe细胞模型建立的示意图。(B) N2A/APPswe细胞中APP和C99-APP的表达水平。统计学显著性通过双尾配对t检验确定。(C)酶联免疫吸附试验(ELISA)定量分析N2a/APPswe细胞中Aβ1-42的浓度。统计学显著性通过双尾非配对t检验确定。(D) Y040-7904处理(5 μM‒20 μM)后N2a/APPswe细胞中APP和C99-APP水平的蛋白免疫印迹结果。统计学显著性通过双尾配对t检验确定。(E) N2a/APPswe细胞中Aβ1-42水平随Y040-7904浓度的变化。统计学显著性通过单因素方差分析(One-way ANOVA)及Dunnett多重比较检验确定。(F) Y040-7904处理(100‒1000 μM)后CL4176线虫中β-淀粉样蛋白1-42水平的蛋白免疫印迹结果。(G)图A中β-淀粉样蛋白1-42水平的定量分析结果。(H) Y040-7904处理后CL4176线虫的瘫痪百分比。实验独立重复两次,每次≥100只线虫。统计学显著性通过双尾非配对t检验确定。(I) Y040-7904处理后的CL2006线虫的瘫痪百分比。实验独立重复两次,每次≥100只线虫。统计学显著性通过双尾非配对t检验确定。(J) Y040-7904处理后的N2A/APPswe细胞Parkin、PINK1和LC3II/I的蛋白水平。(K) 蛋白免疫印迹结果显示在PINK1沉默情况下,Y040-7904处理后N2a/APPswe细胞中APP的水平。统计学显著性通过单因素方差分析(One-way ANOVA)结合Tukey多重比较检验进行判定。
综上,本工作构建了AI辅助显微荧光成像技术实现线粒体自噬全过程的动态、定量可视化,并利用其筛选出了新型线粒体自噬诱导剂,并在线虫模型上验证了其在缓解AD病理作用。创新点在于:(1)开发出系列线粒体靶向pH比率响应型荧光探针,提出在活细胞中,对线粒体进行pH和形态学双模态可视化分析策略。(2)构建了AI辅助活细胞显微荧光成像平台AI-FM,将荧光图像与AI模型相结合,动态、实时获取线粒体自噬中间体类型、比例及空间分布信息,以及线粒体自噬中间体空间分布图。(3)通过虚拟筛选和AI-FM验证,获得新型线粒体自噬诱导剂Y040-7904,并且阐明其通过SIRT1/FoxO3/PINK1/Parkin途径提高线粒体自噬水平。(4)在AD神经元细胞模型和线虫模型中均验证了Y040-7904对AD病理的缓解作用,为AD药物发现提供了新的候选化合物。
复旦大学药学院博士生王艺澄、复旦大学信息科学与工程学院博士生宋鹏斐、复旦大学药学院博士生周荷清为本文共同第一作者。复旦大学药学院李聪教授、游艳青年研究员,复旦大学信息科学与工程学院余锦华教授,及云南大学药学院雷祖海教授为本文的通讯作者。该工作获得国家科技部重点研发项目,国家自然科学基金项目,上海市科技项目和复旦大学AI for Science的支持。