癫痫影响全球超过5000万人,尽管目前有超过20种抗惊厥药物,仍有30-40%的患者无法通过药物控制癫痫发作。耐药性癫痫患者(DRE)往往并发其他神经类疾病,导致生活质量下降、社会歧视以及死亡风险显著增加。对于局灶性DRE患者而言,手术切除致痫灶是癫痫治疗有效手段。尽管可通过手术干预获益的DRE患者比例在10%-50%,但由于致痫灶定位的复杂性和高昂医疗费用,每年只有不到3%的DRE患者最终从手术治疗获益。此外,致痫灶不完整切除导致30%-50%的DRE患者手术后仍然经历反复发作,预后不佳。
临床有多种致痫灶术前定位技术,包括症状学分析、视频脑电和磁共振成像(MRI)、发作间期正电子发射断层扫描(PET)和发作期单光子发射计算机断层扫描(SPECT)。如果通过上述非侵入性技术仍无法界定致痫灶,则可能需要使用立体脑电图(SEEG)进一步的检查。然而,SEEG的空间分辨率受限,只能识别出感兴趣区域,而不是精确边界。此外,脑漂移等因素会导致术前与术中定位空间信息不一致,从而使得完全切除致痫灶变得更加困难。皮层脑电图(ECoG)是临床术中定位致痫灶的金标准,也是唯一的技术手段。尽管ECoG提供了良好的时间分辨率,但它存在以下局限性:(1)受麻醉影响大,神经元放电极易受到麻醉的作用被抑制,而麻醉剂在术中不可或缺,因此大大降低了术中使用ECoG定位致痫灶的准确度和灵敏度;(2)可操作性差,神经元痫样放电具有瞬时性及时空动态变化等特点,为了获得准确可靠的致痫灶脑电信息,通常需要延长采样及麻醉时间,增加手术风险及外科医生的疲劳度;(3)数据解读主观性强,临床ECoG数据十分依赖医生的经验,导致手术切除主观性较强。在过去的几十年里,自发光学信号成像、电压敏感染料和光声成像等技术已被开发用于致痫灶的准确定位。然而,这些成像策略仍然依赖于捕捉偶发且脆弱的神经元电活动,使得术中应用较为困难。因此,开发抗麻醉干扰、稳定可靠的致痫灶术中定位技术,对于扩大癫痫手术适用人群、改善患者预后具有重要意义。
小胶质细胞是大脑中的驻留免疫细胞,在维持脑内稳态和介导神经免疫方面发挥着重要的生理作用。小胶质细胞炎性激活可能会通过释放促炎因子或干扰神经元回路降低癫痫发作阈值并促进癫痫发生。最新研究表明,在癫痫患者和动物模型中,小胶质细胞的炎性激活是致痫灶显著特征。而髓过氧化物酶(MPO),一种参与氧化组织损伤和免疫防御的关键炎症酶,在脑内激活的小胶质细胞中显著上调。因此,我们假设通过可视化MPO为术中定位致痫灶提供新策略。
在本研究中,基于临床DRE患者组织样本,我们发现致痫灶内促炎小胶质细胞累积显著增加,可作为可靠生物标志物。进一步,我们开发了一种超亮比率式表面增强拉曼(SERS)探针,具有皮摩尔级别的灵敏度。借助该探针,我们实现活体癫痫小鼠模型致痫灶精准定位及手术切除。与ECoG策略相比,该SERS引导策略具有以下优势:(1)抗麻醉干扰;(2)具有长时程且稳定的致痫灶成像时间窗口(>1小时);(3)将炎性小胶质细胞的空间分布转化为直观可见的拉曼信号;(4)易于与其他辅助手段如术中神经监测结合使用,在最大限度切除致痫灶的同时保留脑功能区。总之,这项工作提出了一种引导癫痫手术的替代策略,有望提高DRE患者的手术疗效。
近日,复旦大学、复旦大学附属华山医院、中科院深圳先进院联合研究团队在Cell Rep Med杂志上发表了题为:“Ultrabright Ratiometric Raman-guided Epilepsy Surgery by Intraoperatively Visualizing Proinflammatory Microglia”(超亮比率型拉曼探针可视化促炎小胶质细胞引导癫痫手术)的论著。项目团队提出以促炎小胶质细胞高表达MPO作为致痫灶标志物,通过构建比率响应型拉曼探针,定量成像促炎小胶质细胞高表达的髓过氧化物酶,实现术中致痫灶的高灵敏、高信噪比勾勒。总之,本工作不仅为临床致痫灶的术中定位提供了新技术,也为癫痫诊疗提供分子尺度可视化的工具。
促炎性小胶质细胞在DRE患者癫痫病灶中聚集
为了阐明致痫灶中小胶质细胞的激活,我们采集了患者头皮EEG、MRI、18F-FDG PET及TSPO PET成像,并对手术切除的脑组织样本进行验证(图1A)。临床表现和EEG均证实DRE患者的痫样发作(图1B)。为了活体评价小胶质细胞的激活,我们使用靶向18-kDa线粒体转位蛋白(TSPO)的放射性示踪剂18F-DPA-714对患者进行PET/CT图像。我们观察到发作间期18F-FDG PET显示低代谢区域、T1加权(T1W)MRI显示结构异常的区域以及18F-DPA-714摄取增加的脑区相吻合(图1C)。进一步对手术切下来的组织进行全细胞膜片钳分析,结果显示与没有癫痫史患者的对照脑组织相比,DRE患者样本中的神经元兴奋易感性增强(图1D)。流式细胞术结果表明癫痫组织中促炎性小胶质细胞(CD86+CD11b+CD45mid+)的比例较对照组织增加了4.4倍(图1E和1F)。免疫荧光结果激活的小胶质细胞中MPO表达增加(图1G)。上述研究表明由促炎性小胶质细胞产生的高MPO水平可作为致痫灶识别的生物标志物。
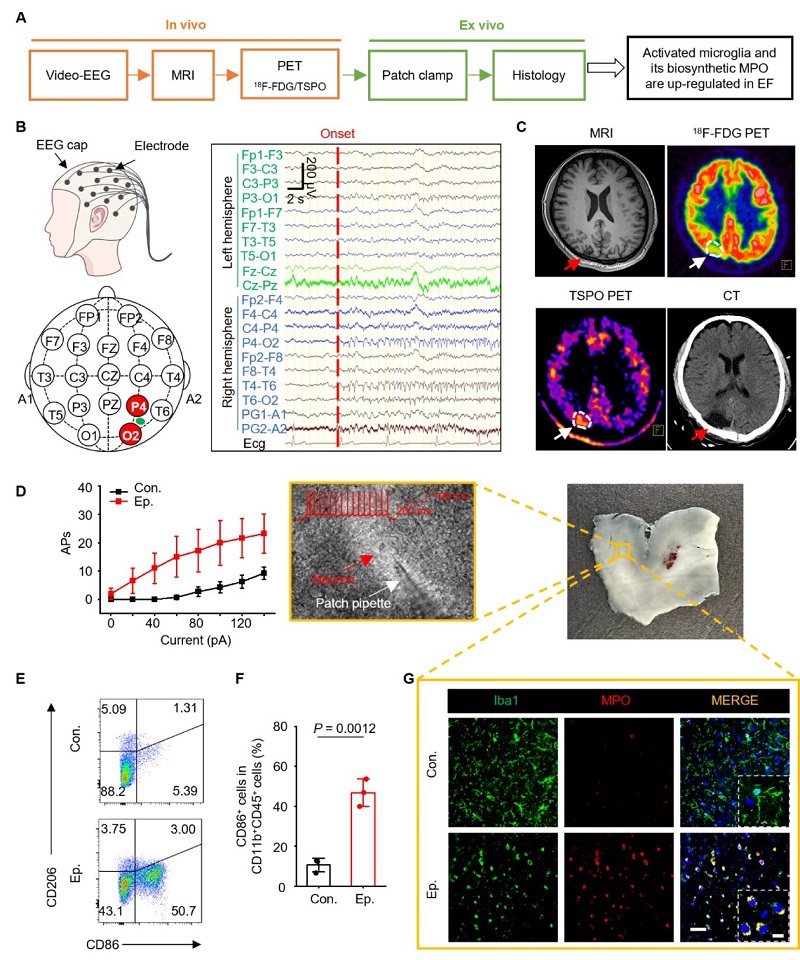
图1. 难治性癫痫患者致痫灶内促炎型小胶质细胞积聚增加。 (A) 实验流程图。(B) DRE患者头皮EEG示意图(左);一名22岁复杂部分性发作DRE患者的代表性发作期EEG记录(右)。在右侧顶枕区O2和P4电极处发现了频繁尖波的EEG起始点(红色虚线)。(C) DRE患者的术前T1加权MR、¹⁸F-FDG、TSPO PET成像以及术后CT图像。箭头指示右侧顶枕区。(D) 左,由0-pA到140-pA范围内,外加电流诱导的动作电位数量;中,新皮质切片膜片钳采集明场图像;右,来自DRE患者的新鲜标本照片。(E和F) 流式细胞术分析(E)及定量(F)显示从癫痫和对照患者切除组织中的促炎性小胶质细胞(CD86+CD11b+CD45mid+)。(G) 免疫荧光染色评估癫痫和对照脑组织中MPO与Iba1的共定位,比例尺:50 μm和5 μm。
SERS探针的设计与表征
为开发具有高灵敏度、可定量的表面增强拉曼散射(SERS)探针,我们采用了计算机辅助拉曼报告分子设计(CARRD)策略,筛选了总计17种分子结构骨架、36种化合物,并获得了两种具有高拉曼活性且光谱不重叠的报告分子(图2A和2B)。通过将对MPO/HOCl响应的拉曼报告分子Lip-Cy7S、不响应的内参拉曼分子Lip-NB及血脑屏障(BBB)穿透肽angiopep2等功能基团结合到金纳米粒子表面,我们开发了一种超亮比率响应型SERS传感器(简称ultraHOCls)。在Au表面修饰PEG和angiopep2后,ultraHOCls的表面电荷从负电荷(-19.0±3.4 mV)转变为接近中性的ζ-电位(5.5±1.6 mV)。傅里叶变换红外光谱和拉曼光谱均显示了ultraHOCls的成功合成。UltraHOCls为星形形态,水动力直径为110.3±5.9 nm,在体外显示出优异的储存稳定性和光稳定性。此外,ultraHOCls组织穿透深度约为3.0 mm,并在小鼠血浆中的检测限低至2.0 pM,比目前用于HOCl检测的分子探针(通常约为nM级别)高出数个数量级(图2C,2D)。UltraHOCls与HOCl响应后,518 cm-1处的拉曼峰强度(I518)显著降低,而586 cm-1处的SERS强度(I586)几乎不变,可作为定量内置校正峰(图2E,2F)。UltraHOCls对HOCl表现出快速响应,超过90%的拉曼信号变化在1分钟内完成(图2G)。重要的是,ultraHOCls对HOCl具有高度特异性,相对于内源性金属离子、生物分子及其他类型的ROS/RNS的选择性超过6-20倍(图2H)。重要的是,当pH值从10.5降至1.5时,ultraHOCls的I586/I518 SERS强度比率保持不变,表明ultraHOCls对HOCl的响应性与生理pH无关。综上,ultraHOCls能够以高准确性和时间分辨率测量HOCl浓度。
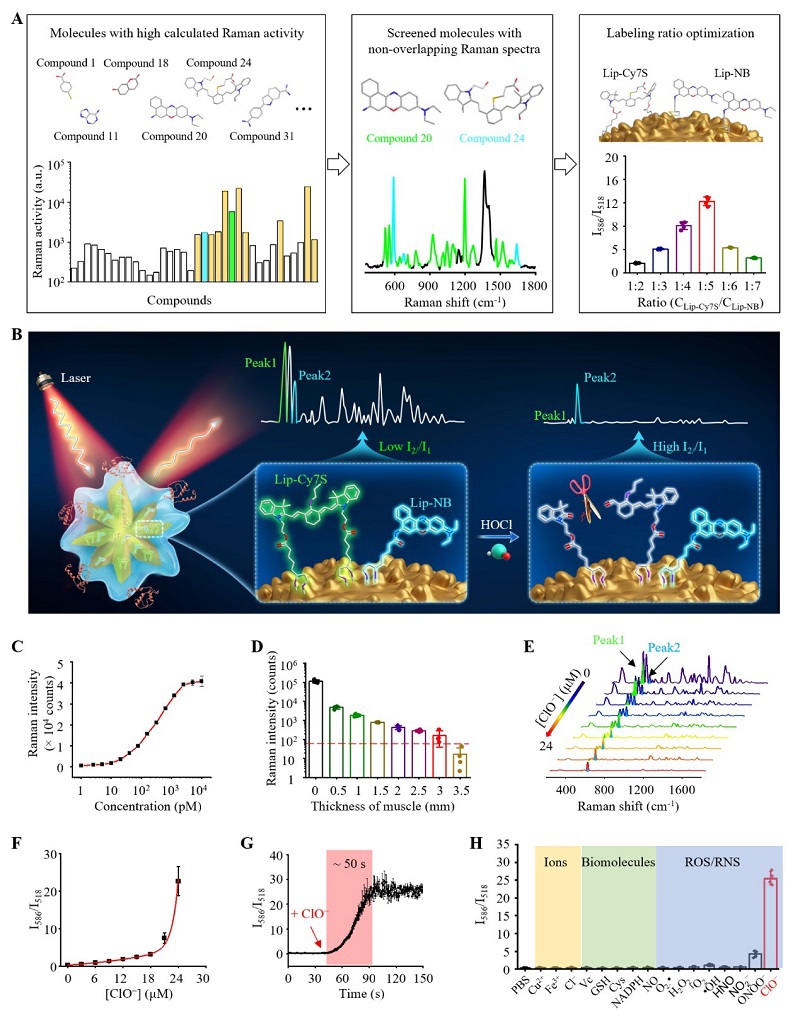
图 2. UltraHOCls的设计和表征。 (A) CARRD辅助筛选和优化拉曼报告分子构建超亮比率型SERS传感器。(B) UltraHOCls响应HOCl的机制示意图。(C) 不同浓度下ultraHOCls的拉曼信号强度。(D) UltraHOCls体外穿透性测试。(E) 不同HOCl浓度下ultraHOCls的拉曼光谱。(F) 拉曼强度比值与HOCl浓度的关系。(G) UltraHOCls响应HOCl后I586/I518比值的动态变化。(H) UltraHOCls的体外抗干扰性测试。
探针UltraHOCl体外成像促炎性小胶质细胞
UltraHOCls优良的拉曼特性启发我们探索其在细胞层面识别小胶质细胞表型的能力。我们从新生小鼠脑中制备原代小胶质细胞,然后通过细胞因子干扰素γ(IFNγ)和/或内毒素脂多糖(LPS)进行条件化处理,使其向促炎表型极化,或者用IL-4刺激使其向抗炎表型极化(图3A)。与PBS处理的小胶质细胞相比,LPS+IFNγ处理的小胶质细胞中MPO的mRNA(3.4倍)和蛋白质(2.0-14.8倍)表达水平显著增加(图3B, 3C)。随后,我们研究了ultraHOCls在小胶质细胞中的细胞摄取动力学,发现孵育后仅30分钟即可观察到明显的摄取,LPS+IFNγ处理的小胶质细胞比PBS处理的对照组显示出更高的I586/I518比率,并且该比率在2小时后达到稳定。为了测试ultraHOCls可视化不同表型小胶质细胞的能力,我们对暴露于不同刺激条件下的小胶质细胞进行了比率SERS成像。与PBS处理的小胶质细胞相比,在用梯度浓度的LPS刺激的细胞中,I518逐渐减少而I586几乎保持不变(图3D-3F)。当使用600 ng/mL LPS加上100 ng/mL IFNγ孵育时,观察到I586/I518比率增加最大,表明促炎性小胶质细胞中的HOCl水平升高。相比之下,IL-4刺激的细胞中I586/I518比率只有微小变化。进一步地,使用MPO抑制剂水杨酸羟胺(SHA)显著减弱了由LPS+IFNγ引起的I586/I518比率增加,这表明ultraHOCls对MPO水平的升高非常敏感(图3D-3F)。上述发现得到了流式细胞术分析的证实,所有这些结果表明我们的探针可以特异性识别促炎性小胶质细胞中升高的MPO/HClO(图3G-3H)。以上体外细胞的研究显示了利用ultraHOCls的比例传感可视化促炎性小胶质细胞的可行性。
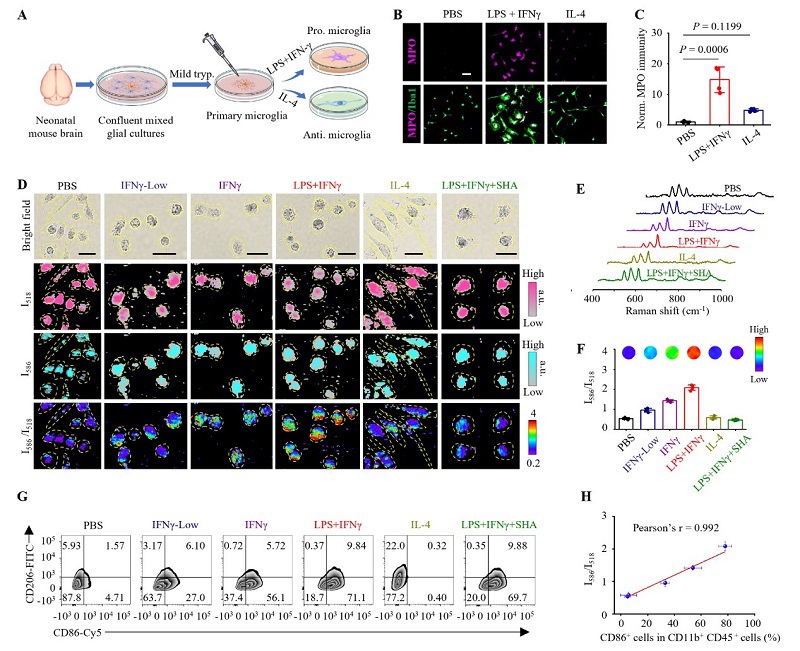
图3. UltraHOCls成像促炎小胶质细胞。 (A) 原代小鼠小胶质细胞分离和极化示意图。(B) 激活的小胶质细胞中Iba1和MPO的免疫荧光染色图像。比例尺,50 μm。(C) 小胶质细胞中MPO免疫染色的定量分析。(D) UltraHOCls成像不同处理后的小胶质细胞共聚焦拉曼显微成像。IFNγ-Low:40 ng/mL IFNγ;IFNγ:100 ng/mL IFNγ;LPS+IFNγ:600 ng/mL LPS加100 ng/mL IFNγ;IL-4:40 ng/mL IL-4;LPS+IFNγ+SHA:600 ng/mL LPS加100 ng/mL IFNγ随后加入SHA(500 μM)。比例尺,30 μm。(E) 图像中标记区域收集的典型拉曼光谱。(F) 平均I586/I518比值。(G) 不同处理后的原代小胶质细胞表型极化的流式细胞术分析。(H) I586/I518比值与CD86+小胶质细胞百分比的关系图。
探针UltraHOCl在体定位小鼠致痫灶
为了评估ultraHOCls在定位致痫灶方面的性能,术中皮层脑电图(ECoG)被用作参考的“金标准”。如图4A所示,我们制作了一个面积约为11×7 mm²、包含64个电极(64E)的微阵列,并以高空间分辨率定位了慢性发作小鼠模型中的致痫灶(图4B)。在静脉注射ultraHOCls后,我们在电极位置收集了拉曼光谱。重要的是,具有高I586/I518比率的脑区与通过64E阵列识别的癫痫病变区域很好地共定位,0.6的I586/I518比值可作为区分正常和癫痫小鼠脑组织的截断值(图4C, 4D)。相比之下,带有“始终开启”拉曼信号的对照探针Ang-NB显示低E/N比率和非靶结合。为进一步证实ultraHOCls成像的特异性,我们使用PLX5622处理KA诱导的癫痫小鼠模型以实现小胶质细胞耗竭。拉曼成像结果显示,与对照组相比,小胶质细胞耗竭组的E/N比显著降低。上述研究说明了ultraHOCls通过靶向激活的小胶质细胞来定位致痫灶的有效性。
ECoG的主要局限性之一是其较长的采样时间,这主要是由于捕捉瞬时且短暂的神经活动存在难度。正如预期的那样,尽管时间依赖性的ECoG能够揭示癫痫活动,但瞬时ECoG电位迅速下降,并在数十秒内返回基线水平(图4E和4F)。相比之下,ultraHOCls在致痫灶检测到的高I586/I518比率至少持续了1小时,这为外科医生提供了稳定的成像时间窗口,使其操作更为便捷(图4E和4F)。这意味着使用ultraHOCls进行成像不仅克服了ECoG在时间上的限制,还提供了更长时间稳定信号的优势,使得手术过程中对致痫灶的定位更加准确。
麻醉对ECoG信号的影响是癫痫手术中的另一大挑战。为了研究麻醉对使用ultraHOCls定位致痫灶的影响,我们设计了异氟醚麻醉-清醒测试。如图4G所示,在停止异氟醚给药后,我们在致痫灶处记录到了具有高比率值的生物电信号。然而,当恢复异氟醚麻醉后,ECoG电位显著下降,仅记录到比率值小于1.0的背景信号。相比之下,即使在没有异氟醚麻醉干扰的情况下,位于致痫灶的ultraHOCls的拉曼信号强度和I586/I518比率(>2.5)也没有受到影响(图4G和4H)。为进一步评估静脉麻醉剂和不同麻醉深度对拉曼信号的影响,我们通过静脉给予不同剂量的丙泊酚均干扰了ECoG检测。改变丙泊酚剂量表明,无论是麻醉的存在还是麻醉深度都没有影响拉曼信号。这些结果凸显了ultraHOCls引导手术在准确定位致痫灶方面的优势,无需担心麻醉干扰。这意味着ultraHOCls可以在不受麻醉影响的情况下提供稳定可靠的致痫灶定位,极大地提高手术的准确性和效率。
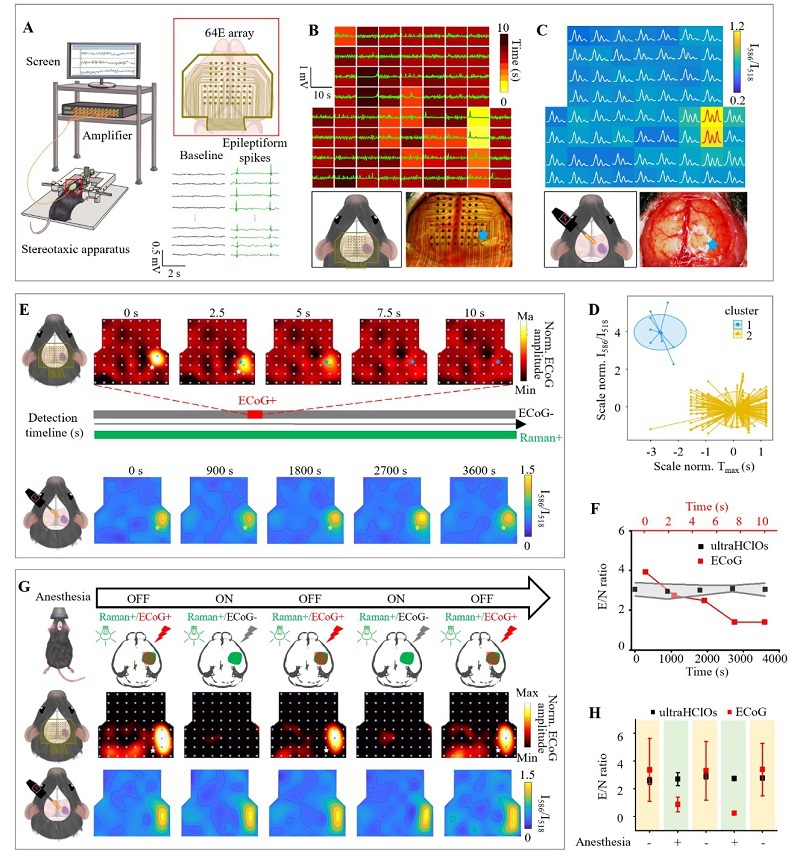
图 4. UltraHOCls术中定位致痫灶比ECoG具有更好的性能。(A) ECoG原位监测KA诱导的癫痫模型小鼠的示意图。(B) 通过64导ECoG电极采集KA癫痫模型小鼠脑电信号,星号代表致痫灶。(C) UltraHOCls展示出了与64导ECoG电极阵列相媲美的定位精度。(D) 对由UltraHOCls和ECoG确定的致痫灶数据进行均值聚类分析。(E) 动态ECoG map成像显示致痫灶内神经元瞬时超兴奋性,在发作开始后10秒内迅速衰减至基线。相比之下,ultraHOCls在1小时的操作时间窗口内持续定位致痫灶。(F) E/N比率和ECoG幅度的时间演变。(G) 在麻醉“开-关”周期中,活体模型小鼠脑部的拉曼/ECoG信号map图。+,2%异氟烷麻醉;-,移除麻醉;Raman+/ECoG+,阳性拉曼/ECoG信号;Raman+/ECoG−,阳性拉曼信号但仅背景ECoG信号。(H) 使用或不使用麻醉处理的KA诱导的癫痫模型小鼠中ultraHOCls和ECoG的E/N比率。
我们进一步探索了ultraHOCls检测致痫灶的分子机制。我们将具有高I586/I518比率(>0.6)的脑区定义为癫痫组织并进行手术切除,而低I586/I518比率(<0.6)的区域则作为正常对照组(图5A和5B)。离体电生理学研究证实,癫痫组织中的神经元比对照组织中的更易兴奋(图5C)。此外,与对照组织相比,在癫痫组织中观察到促炎小胶质细胞的比例增加了10.86倍(图5D)。MPO表达和HOCl浓度也显示出显著上调(图5E, 5F)。透射电子显微镜(TEM)图像显示,致痫灶内ultraHOCls的平均密度为4.77±3.11个/μm²,这是正常脑组织中的2.5倍(图5G)。UltraHOCls特异性地递送至癫痫组织进一步提高了在体内以高灵敏度和选择性定位促炎性小胶质细胞的能力。这些结果证明了使用我们的纳米传感器通过成像促炎性小胶质细胞来术中定位致痫灶的可行性。
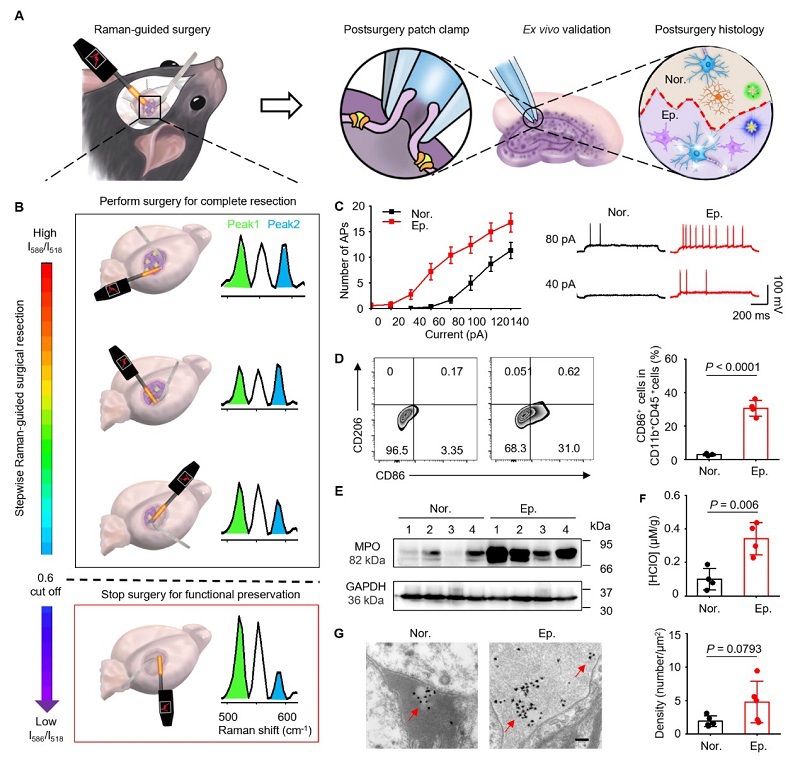
图 5. UltraHOCls可视化促炎小胶质细胞引导癫痫手术。 (A) UltraHOCls引导癫痫手术策略示意图。(B) 左侧:UltraHOCls引导致痫灶切除实验示意图;右侧:手术过程中收集的代表性拉曼光谱。(C) 来自癫痫模型小鼠切除切片神经元的膜片钳记录。左图:由0-pA至140-pA范围内的电流注射诱导的动作电位(APs)数量。右图:通过注入40-pA和80-pA电流诱导的代表性细胞放电。(D) 代表性流式细胞术结果及KA诱导的癫痫模型小鼠切除的癫痫组织与正常组织中促炎性小胶质细胞(CD86+CD11b+CD45mid+)的定量分析。(E) 癫痫模型小鼠切除的癫痫组织与正常组织中MPO表达的Western blot分析。(F) 癫痫和正常脑匀浆中的HOCl浓度。(G) 代表性TEM图像及癫痫模型小鼠切除的癫痫组织与正常组织中UltraHOCls的定量分析。比例尺为200 nm。红色箭头指示大脑中的金纳米粒子。
UltraHOCls引导手术减轻了KA模型鼠的癫痫发作
为了评估ultraHOCls在引导癫痫手术中的效果,我们将慢性癫痫模型小鼠随机分为五组:(i) 未进行手术的假开颅(EP-C)组,(ii) ECoG引导的手术(ECoG-S)组,(iii) UltraHOCls引导的手术(ultraHOCls-S)组,(iv) Ang-NB引导的手术(Ang-NB-S)组,以及(v)仅接受静脉注射ultraHOCls的ultraHOCls-C组(图6A)。视频-EEG记录结果显示,SERS和ECoG引导的手术均显著降低了癫痫发作的严重程度(图6B和6C)。与EP-C组相比,ultraHOCls-S组在8小时内的癫痫发作频率总体减少了83%,小鼠的总发作时间减少了83%(图6D, 6E)。与Ang-NB-S组相比,ultraHOCls-S组显示癫痫发作频率减少了67%,发作总时长减少了66%。值得注意的是,与ECoG引导的手术相比,ultraHOCls引导的手术导致癫痫发作频率减少63%,总发作时间减少61%,这可能是由于其在术中定位致痫灶的便捷性,特别是对于深部和微小的致痫灶。重要的是,ultraHOCls-C组与EP-C组相比,在癫痫发作频率和总发作时长上没有显著差异,表明单独使用ultraHOCls对神经活动没有明显影响(图6B-6E)。对术后组织边缘进行的膜片钳实验显示,ultraHOCls在指导癫痫灶完整切除方面超越了其他技术。综上所述,ultraHOCls引导的手术比之前的策略能更有效地缓解慢性癫痫模型小鼠的癫痫发作。
为了评估手术对癫痫相关行为和功能改变的影响,我们测试了小鼠相关的情绪失调、运动协调性和记忆(图6F)。在开放场测试中,与EP-C组相比,ultraHOCls引导的手术显示了有效的治疗效果,总距离减少了49%,边缘速度减少了50%,从而缓解了过度活跃的症状(图6G, 6H)。同样地,在高架十字迷宫测试中,与ultraHOCls-S组相比,EP-C和ECoG-S组显示出更高的活动性,如总距离和总速度。在悬尾实验中,我们发现与EP-C组相比,不动时间和活跃时间没有显著变化。这些结果表明,ultraHOCls在缓解与癫痫相关的过度活跃方面是有效的。这意味着使用ultraHOCls不仅能够帮助精确定位并切除致痫灶,还能改善由癫痫引起的行为异常,进一步验证了该技术在癫痫治疗中的潜在价值。
在Catwalk步态分析中(图6I, 6J),我们发现除Ang-NB-S组外,各测试组在包括节奏、速度和摆动在内的分析步态参数上没有统计学差异。相反,我们观察到脚印面积和最大强度有明显减少,这表明Ang-NB引导的手术可能会损害小鼠的运动功能。在加速转棒测试中进一步证实了类似的运动协调趋势。上述结果表明,由于非特异性成像和切除致痫灶,Ang-NB引导的手术可能影响运动功能,而使用ultraHOCls进行的比例手术可以避免这种问题。这意味着ultraHOCls不仅能够更准确地定位和切除致痫灶,还能减少对周围健康组织的影响,从而保护患者的运动功能不受损害。进一步强调了ultraHOCls技术在提高手术精确度和患者术后生活质量方面的潜在优势。
在莫里斯水迷宫测试中,所有其他组的小鼠相比于Nor-C组表现出显著更长的逃避潜伏期、更少的平台穿越次数以及更长的逃避潜伏期,表明海马依赖的空间学习和记忆受损(图6K-6N)。然而,在Y迷宫测试中,各组之间在变化次数、进入臂的次数或行进距离上没有统计学差异,这表明患有慢性癫痫并接受手术治疗的小鼠在工作记忆方面没有明显的损伤(图6O, 6P)。不出所料,所有行为测试结果显示EP-C和ultraHOCls-C组之间几乎没有差异。这些结果表明,仅接受UltraHOCls注射的小鼠对工作记忆、空间记忆、运动协调性和焦虑没有影响。综上所述,所有这些行为和功能数据表明,我们采用UltraHOCls引导的手术策略能够在不明显损害运动功能或加重记忆缺陷的情况下,缓解与癫痫相关的过度活跃。
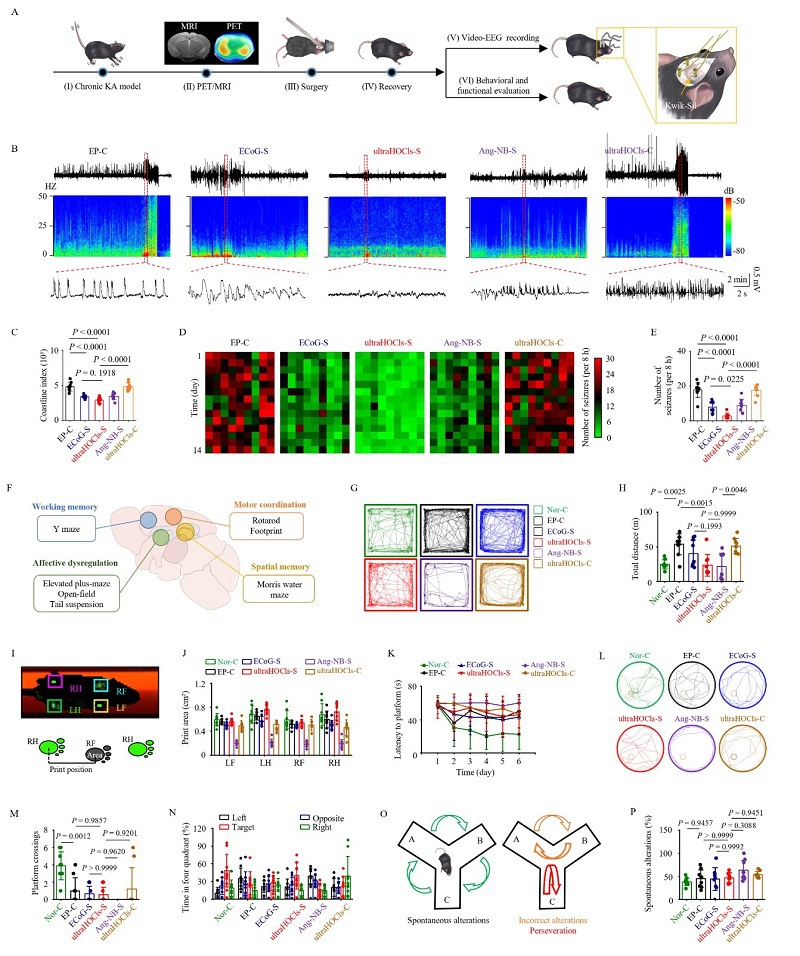
图6. UltraHOCls引导手术减轻了小鼠癫痫发作并保护了神经功能。 (A) 实验流程图。(B) 各实验组代表性EEG、能谱图及EEG轨迹水平扩展图。(C) EEG海岸线指数的量化。(D) 在14天内,每个小鼠的癫痫样活动热图。(E) 阵发性放电的癫痫发作频率。(F) 行为测试的实验方案及关键主导脑区示意图。(G) 旷场测试小鼠10分钟运动轨迹图。(H) 旷场测试中的总行走距离。(I) 代表性Catwalk步态分析测试图和参数示意图说明。(J) Catwalk步态分析中印迹面积量化。(K) Morris水迷宫训练。(L) Morris水迷宫实验轨迹图。(M) 和 (N) 试验中平台穿越次数(M)和在目标象限停留时间(N)的量化统计。(O) Y迷宫测试中自发交替(正确交替)、错误交替示意图。(P) Y迷宫测试中自发交替百分比。
UltraHOCls成像DRE患者离体癫痫组织
为了测试ultraHOCls在更贴近临床的实际情境中术中定位癫痫区域的可行性,我们首先通过膜片钳技术验证了从患者身上切除的新鲜脑标本中癫痫放电的存在(图7A)。然后,在脑组织切片上喷洒了ultraHOCls溶液,并观察到与对照组织相比,癫痫组织中的I586/I518比率增加了超过2倍(图7B-7E)。此外,病理检查确定了较高的I586/I518比率区域确实为癫痫组织(图7D)。接下来,我们进行了受试者ROC分析,使用I586/I518比率区分癫痫病变与非癫痫的人类脑组织,并确定了一个截断点0.71,该点的敏感性为94.89%,特异性为93.3%(图7F)。曲线下面积值为0.98(95%置信区间:0.975–0.988),表明使用ultraHOCls区分癫痫组织和对照组织具有很强的鉴别能力。值得注意的是,我们观察到I586/I518比率、神经元电活动以及MPO表达水平之间存在强烈的正相关性(图7G)。上述研究证明了ultraHOCls在临床相关情境中定位致痫灶的可行性。
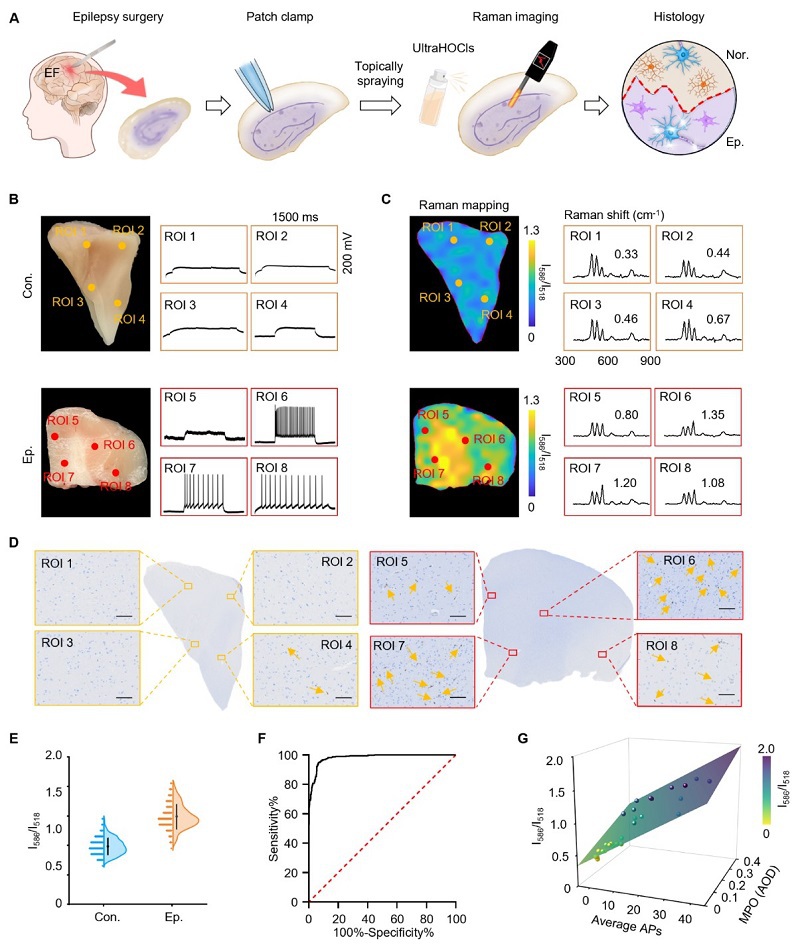
图 7.UltraHOCls成像来自DRE患者切除组织样本癫痫病灶。(A) 实验流程示意图。(B) DRE患者和对照患者的切除新鲜标本中选定ROI注射0-pA电流诱导的动作电位(AP)序列的照片及其对应的AP序列。(C) 在脑切片选定ROI喷洒ultraHOCls后的拉曼信号mapping图及典型拉曼光谱。(D) 来自DRE患者和对照患者切除组织中的MPO免疫组化。比例尺为100 μm。(E) 喷洒ultraHOCls后脑切片中I586/I518比值的小提琴图。(F) ROC曲线显示ultraHOCls在区分癫痫组织与非癫痫组织方面的性能。(G) I586/I518比值与MPO表达及由0-pA至140-pA范围内的电流注射诱导的平均动作电位序列数量成正比。
讨论
尽管临床对癫痫手术有巨大的人口需求,但其广泛应用即使在发达国家仍然受限,这可以归因于所需的高额费用。目前,被推荐癫痫手术的患者通常需要接受全面的术前评估以定位致痫灶,这包括高分辨率MRI、视频脑电-EEG和详细的神经心理学评估。在上述检测结果不明确的情况下,会使用其他成像方式如PET或SPECT来识别发作间期局部低代谢区域或发作时的高代谢区域。为精确定位疑似致痫灶,临床会进一步采用SEEG进行评估。
致痫灶准确定位对于提高DRE患者的手术效果至关重要。在以往的研究中,我们报道了一种电场响应的MRI探针,通过检测异常神经元放电引起的T1弛豫率变化来增强术前致痫灶的定位。然而,术中定位致痫灶同样十分重要。即使在经过精心筛选的DRE患者中,仍有30%到50%的患者在手术后出现癫痫复发。手术失败的主要原因之一是无法完全切除致痫灶。术中致痫灶定位对于解决如脑移位和边界确定等挑战至关重要,这些因素会显著影响手术结果。虽然术中MRI用于手术期间的定位,但其高昂的成本和较长的成像时间限制了广泛应用。此外,类似于ECoG,MRI探针通过响应神经元放电来增强信号,被术中麻醉所干扰。类似的,已报道的多种用于术中致痫灶定位的光学成像技术同样存在类似的不足。因此,为了提高癫痫定位准确度、降低成本并拓展可癫痫手术的人群,临床亟需开发长时程、抗麻醉干扰的术中成像技术。
本工作中开发的ultraHOCls通过识别癫痫的分子生物学改变而非仅仅依赖传统的电信号特征,在术中致痫灶定位方面展现了卓越的性能:(1) 稳定性高,术中提供一个稳定且长时程的定位,不依赖于瞬时且偶发的癫痫放电;(2) 兼容性高,其他辅助技术(如术中神经监测)联用,在保留功能区域同时最大化致痫灶切除;(3) 准确度高,在定位致痫灶边界时具有更高的时空分辨率。然而,本研究也存在一定的局限性:ultraHOCls的组织穿透深度仅为3毫米,因此目前需要与现有的术前评估方法(如SEEG)联合使用。然而,一旦其在定位癫痫灶的临床有效性得到进一步验证,也可以进一步开发非侵入性可视化促炎性小胶质细胞的技术用于术前成像,帮助患者跳过SEEG直接进入手术阶段,简化治疗过程。
综上,本工作围绕难治性癫痫致痫灶术中定位困难临床重要挑战,提出以促炎小胶质细胞及其特征代谢分子为靶标的术中致癫灶定位新思路;构建比率响应型表面增强拉曼探针,实现癫痫分子事件在体、高灵敏、定量可视化;克服了现有临床“金标准”ECoG技术存在的易受麻醉干扰、采集时间长、灵敏度低等不足,并在啮齿类动物活体水平及癫痫患者新鲜离体组织水平均实现了致痫灶的准确定位。该工作为致痫灶的术中定位提供了可视化新工具。
复旦大学药学院青年研究员王聪、中山大学肿瘤防治中心神经外科博士研究生李智为本文共同第一作者。复旦大学药学院李聪教授、王聪青年研究员、复旦大学附属华山医院毛颖教授、陈亮教授、联合复旦大学类脑研究院肖晓教授、中科院深圳先进研究院郑海荣教授为本文共同通讯作者。该工作获得国家科技部重点研发项目,上海市科委计划项目,国家杰出青年科学基金,国家自然科学基金项目和上海市科技项目的支持。
原文链接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(25)00228-9