胶质瘤作为最常见恶性脑部原位脑瘤,手术切除是首选治疗手段。由于胶质瘤细胞脑内侵袭的复杂性和异质性,精准界定肿瘤边界面临挑战。不完整切成造成恶性组织残留导致肿瘤快速复发,而过度切除则可能造成脑神经功能损伤。2021年世界卫生组织(WHO)第五版中枢神经系统肿瘤分类指南将分子特征作为胶质瘤分类标准,其中异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)基因成为分子分型的核心指标。IDH1是三羧酸循环关键限速酶,其突变型(R132H等)会产生致癌代谢物D-2-羟基戊二酸(D-2HG),其干扰DNA和组蛋白去甲基化过程,导致细胞表观遗传程序紊乱,促进肿瘤细胞去分化与增殖。IDH1快速分型对提高手术预后具有临床意义。IDH1野生型肿瘤通常对术后放化疗响应不佳,临床推荐尽可能安全切除;而IDH突变型则对放化疗响应较好,建议在保留神经功能前提下精准切除。因此,术中IDH1快速分型对优化胶质瘤手术策略,提高手术预后具有重要意义。
现有IDH分型金标准如免疫组化或基因测序,通常需2–5天出具结果,难以在术中提供快速指导。磁共振波谱成像技术(MRSI)虽可通过检测IDH1突变型特有D-2HG代谢物进行分型,但技术门槛较高、耗时长,且易受干扰。解吸电喷雾电离质谱技术(DESI-MS)能够实现2-HG术中定量检测,但难以提供肿瘤内部IDH1分型空间异质性。因此,亟需开发可应用于术中的IDH1快速,精准分型技术,为优化手术切除策略,促进个体化治疗提供技术支持。
IDH1突变不但导致其正常酶催化功能丧失,且获得将α-酮戊二酸(α-KG)还原为D-2HG的异常酶活性。这一代谢性质改变不仅造成突变表型细胞中D-2HG积聚,也扰乱细胞内氧化-还原稳态。与野生型相比,IDH突变型细胞中不但活性氧(ROS)浓度显著升高,并伴随着还原性代谢物谷胱甘肽(GSH)浓度降低。因此,IDH1突变造成的细胞内氧化-还原代谢指征变化为术中IDH1基因分型提供了新思路。
近日,复旦大学药学院李聪教授课题组在Advanced Science(先进科学)杂志上发表了题为:“Artificial Intelligent-Enhanced Metabolite Profiling for Intraoperative IDH1 Genotyping in Glioma Using an Orthogonally Responsive SERS Probe”(基于正交响应SERS探针的AI驱动代谢物分析技术实现脑胶质瘤术中IDH1基因分型)的研究论文。鉴于IDH1突变引发癌细胞代谢重编程并加剧氧化应激,该工作提出同步测定细胞内氧化还原相关代谢物浓度来快速鉴定胶质瘤IDH1基因型的新策略。首先构建了一种表面增强拉曼散射(SERS)探针,可正交测定肿瘤细胞外液中谷胱甘肽和过氧化氢浓度。同时开发了一种DBCNet深度神经网络,将探针拉曼光谱转化为二维图像进行特征提取,并利用多分支结构与度量学习算法优化光谱特征聚类效果。通过SERS探针与DBCNet算法协同,该拉曼光谱分析模型实现了胶质瘤多种肿瘤代谢物的同步定量检测,7分钟内实现了胶质瘤患者术中IDH1基因快速分型。经31例患者术中样本研究,该技术的受试者工作特征(ROC)曲线下面积达0.985,为优化胶质瘤手术方案及个体化治疗策略提供新策略。
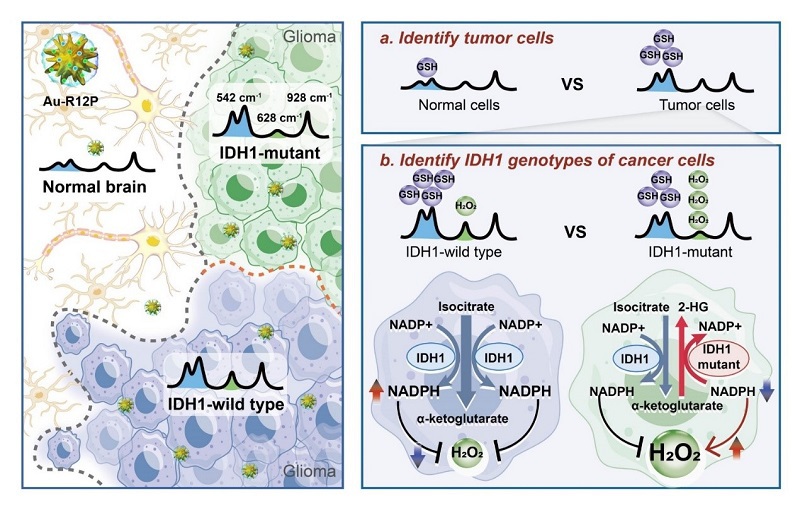
图1. 通过检测氧化还原相关代谢物实现胶质瘤IDH1基因分型
研究团队创新性提出代谢指纹策略,具有以下优势:(1)双靶标设计:针对IDH1突变导致的氧化还原失衡,同步检测谷胱甘肽(GSH)和过氧化氢(H₂O₂)浓度。(2)智能探针:采用表面增强拉曼散射(SERS)技术,通过正交响应信号实现双代谢物无干扰检测。(3)AI赋能:独创二维光谱转化算法,结合多任务深度学习模型,将分析速度提升20倍。
研究团队成功开发出具有正交响应特性的金纳米星SERS探针Au-R12P。该探针创新性地整合了两种特异性拉曼报告分子RR1(响应GSH)和RR2(响应H₂O₂),通过精确调控RR1和RR2摩尔比,实现了双代谢物的同步检测。关键技术突破包括:1)542cm⁻¹(GSH)和628cm⁻¹(H₂O₂)特征峰完全分离;2)利用928cm⁻¹峰作为内参比实现定量校准;3)表面增强共振拉曼散射(SERRS)效应将检测灵敏度提升至50pM。
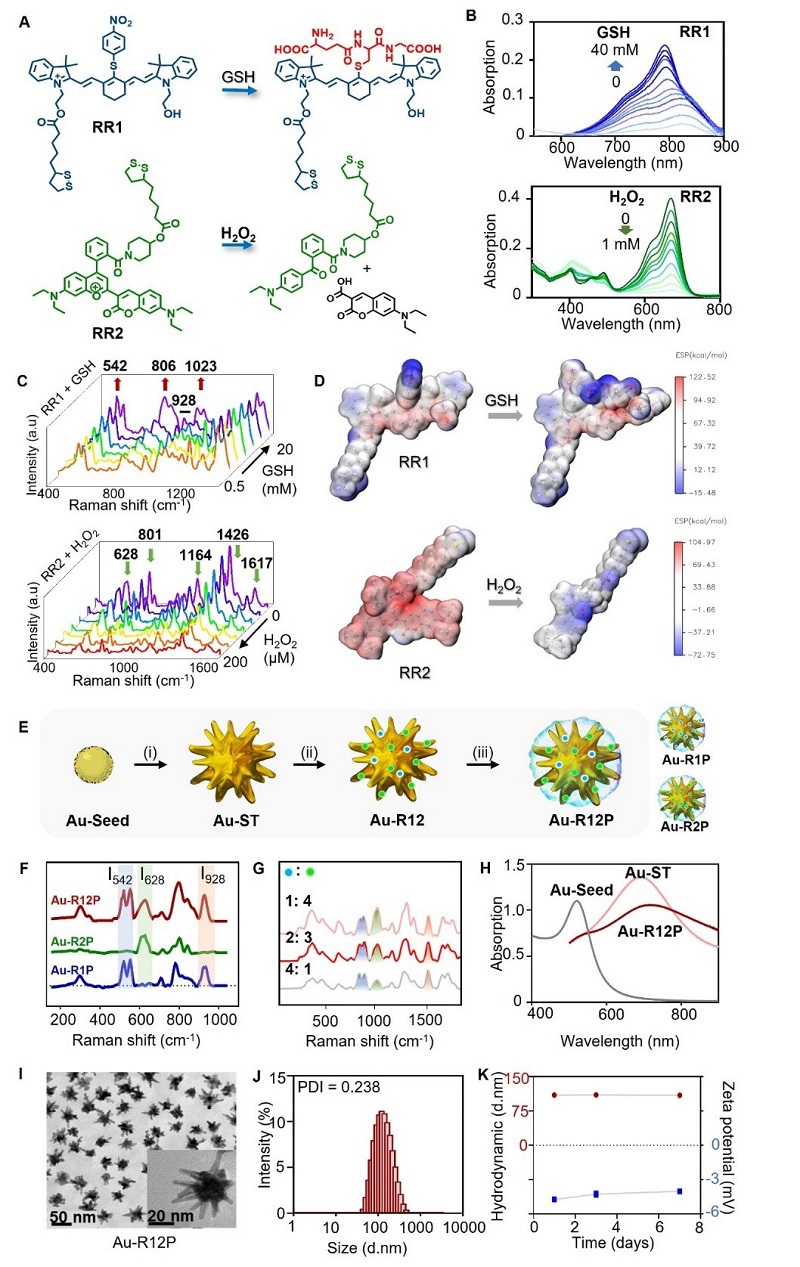
图2. SERS探针Au-R12P的合成与表征。(A)分别响应GSH和H₂O₂的拉曼分子报告基团RR1和RR2的化学结构。(B)RR1和RR2的吸光度随GSH和H₂O₂浓度变化曲线。(C)RR1的GSH依赖性SERS光谱和RR2的H₂O₂依赖性SERS光谱。(D)RR1和RR2分子在GSH/H₂O₂处理前后的静电势(ESP)分布图。(E)Au-R12P合成流程:(i)抗坏血酸/AgNO₃反应40秒(室温);(ii)RR1/RR2修饰1小时(室温);(iii)HS-PEG5k-OCH3孵育12小时(室温)。当步骤(ii)仅添加RR1或RR2时,可分别获得对照探针Au-R1P或Au-R2P。(F)785nm激发下Au-R12P与对照探针的拉曼光谱,可见I542(GSH响应峰)、I628(H₂O₂响应峰)和I928(内参比峰)的完全分离。(G)不同RR1:RR2摩尔比修饰的Au-R12P拉曼光谱。(H)金纳米晶、金纳米星和Au-R12P的水溶液吸收光谱。(I)Au-R12P的透射电镜图(标尺:50nm),插图为局部放大图(标尺:20nm)。(J)Au-R12P的粒径分布及PDI变化。(K)Au-R12P在水溶液中的流体力学直径和ζ电位随时间变化曲线。
团队首创的DBCNet深度学习模型突破了传统算法局限:1)通过相对位置矩阵(RPM)将一维光谱转化为二维特征图;2)采用双分支批相关架构,实现GSH和H₂O₂特征的解耦学习;3)在9600组光谱数据库上的测试显示,其预测精度(R²=0.99)显著优于传统模型,GSH和H₂O₂检测的均方根误差分别降低33%和32%。该模型仅需2ms即可完成单次光谱分析,使得7分钟内完成术中分型成为可能。
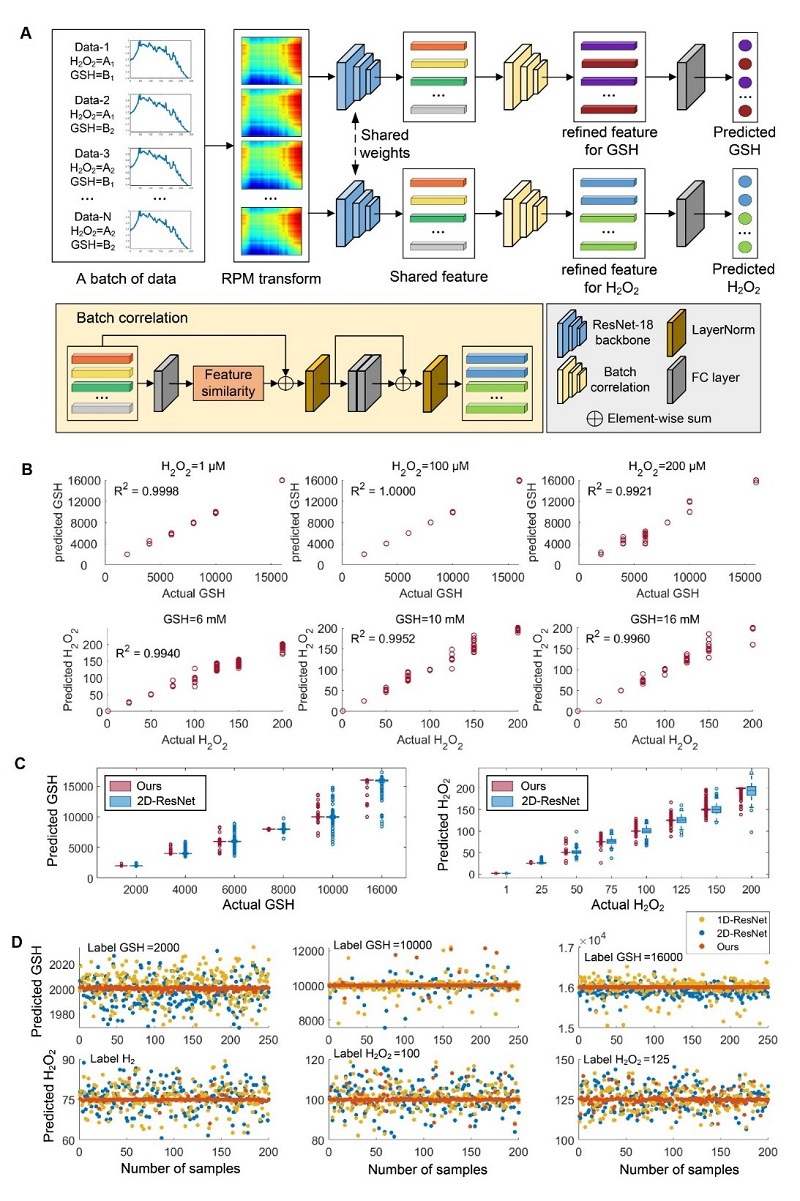
图3. 深度学习模型DBCNet同步测定GSH和H₂O₂。(A)DBCNet算法原理示意图。 (B)DBCNet预测GSH(或H₂O₂)浓度的线性回归图(测试集包含三种不同浓度的H₂O₂或GSH)。(C)2D-ResNet与DBCNet预测GSH和H₂O₂浓度的箱线图对比。(D)1D-ResNet、2D-ResNet和DBCNet三种模型预测浓度的散点分布比较。
在31例胶质瘤患者临床试验中,该系统展现出三大突破:(1)超快响应:7分钟内完成从样本检测到结果输出(传统方法>48小时)。(2)超高精度:受试者工作特征曲线下面积(AUC)达0.985,显著优于现有术中技术。(3)空间解析:可识别肿瘤异质性,精准指导切除边界
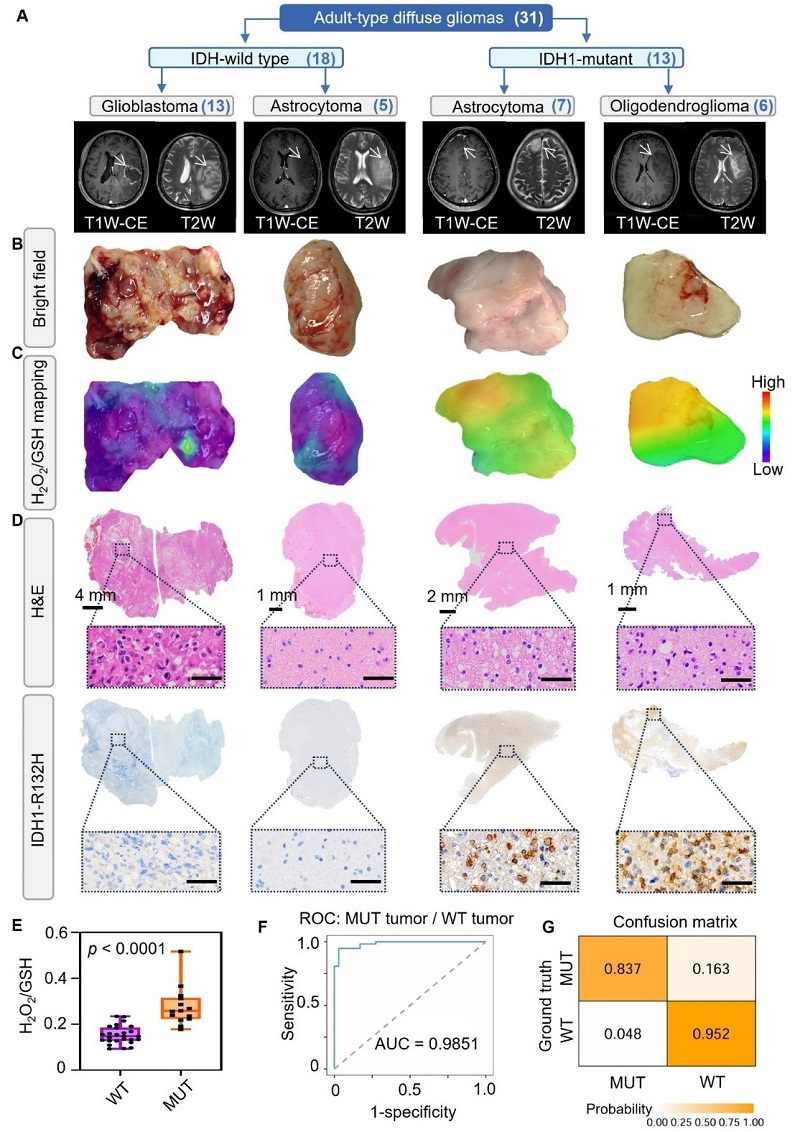
图4. Au-R12P在术中鉴别患者胶质瘤IDH1基因型。(A)世界卫生组织第五版中枢神经系统肿瘤分类与各类胶质瘤的典型T1加权增强(T1W-CE)和T2加权(T2W)磁共振影像。(B)上述各类新鲜切除的胶质瘤组织标本明场照片。(C)切除肿瘤组织的H₂O₂/GSH比率分布图,通过多点采样计算I542/I928(GSH)和I628/I928(H₂O₂)拉曼峰强比生成。(D)图B所示肿瘤组织的H&E染色和IDH1-R132H免疫组化结果(放大图比例尺:40μm)。(E)IDH1野生型(WT)与突变型(MUT)胶质瘤组织的平均H₂O₂/GSH比值比较。(F)基于H₂O₂/GSH比值的逻辑回归模型ROC曲线,用于临床IDH1-WT/MUT分型。(G)两种胶质瘤亚型的混淆矩阵。
复旦大学药学院博士研究生尹航、复旦大学附属华山医院神经外科主治医师张新、复旦大学信息科学与工程学院硕士生赵铮、上海交通大学附属第九医院助理研究员曹崇为本文共同第一作者。复旦大学药学院李聪教授、王聪青年研究员、朱校青年研究员、信息科学与工程学院余锦华教授和华山医院神经外科毛颖教授为本文共同通讯作者。该工作获得国家科技部重点研发项目,国家杰出青年科学基金和上海市科技项目的支持。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202503360