嵌合抗原受体 (CAR) T细胞疗法在治疗血液系统恶性肿瘤方面取得了空前成功,然而其对实体瘤治疗面临多重挑战。首先,肿瘤细胞的可及性:CAR T细胞到达肿瘤实质之前必须克服血管屏障、基质屏障、肿瘤间质液压力等多种生理障碍。其次,肿瘤免疫抑制微环境的负面影响:多种免疫抑制细胞如调节性T细胞、肿瘤相关巨噬细胞和髓系抑制性细胞通过分泌一系列抗炎细胞因子和趋化因子抑制CAR T活性。此外,即使CAR T细胞在肿瘤中存活,但其是否维持对癌细胞的杀伤作用仍需确定。因此,实现CAR T细胞活体条件下肿瘤可及性、生存能力和细胞毒作用成像,对监测并改进CAR T疗效至关重要。各类成像技术中,以正电子发射断层扫描 (PET)和单光子发射计算机断层扫描 (SPECT)为代表的放射性成像兼具高灵敏度、高组织穿透深度、信号可定量等优势,是无创活体评价CAR T细胞的理想工具。
复旦大学药学院李聪教授团队对近年报道的用于CAR T细胞成像的放射性探针、成像策略进行了系统回顾,该工作以题为《实体瘤CAR T免疫疗法的放射性成像:生物分布、瘤内存活和细胞毒性》(Nuclear Imaging of CAR T Immunotherapy to Solid Tumors: In Terms of Biodistribution, Viability, and Cytotoxic Effect)的综述文章发表在《先进生物学Advanced Biology》杂志。该工作首先回顾了CAR T细胞在实体瘤治疗中面临的困境,并从生物分布、瘤内存活和细胞毒性三个方面进行阐述,继而介绍了放射性成像技术评价上述方面的最新进展,最后讨论了各类成像方法的优缺点以及该领域的发展前景及临床转化的挑战。

图1. 放射性成像是研究CAR T细胞实体瘤中生物分布、瘤内存活和细胞毒性的有力工具
目前已开发数种体外标记策略监测CAR T细胞的生物分布。本工作基于标记方法将其分为三类:(1)基于跨细胞膜被动扩散的方法;(2)基于与膜蛋白非特异性结合的方法;(3)基于放射性标记纳米粒子的细胞摄取的方法(图2)。
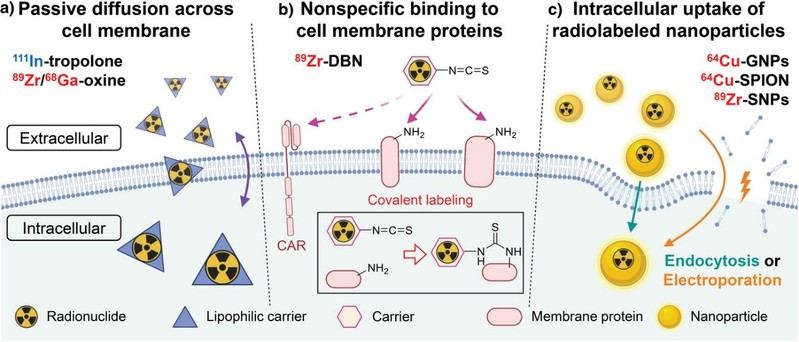
图2. 监测CAR T细胞生物分布的三类体外标记方法
CAR T细胞是“活的”药物,其在体内的存活、增殖是实现治疗效果的先决条件。为此,开发了基于报告基因的成像策略,以指示CAR T细胞的存活情况。报告基因是指编码通常不存在于正常生物体或至少目标区域中的酶、受体和转运蛋白的基因,它们的表达可以很容易地被标记试剂识别。由于只有CAR T细胞表达报告基因,该策略具有标记特异性。此外,因为报告基因表达停止,已经死亡细胞不会被检测,使该技术只追踪活的CAR T细胞。本工作将已有CAR T细胞报告基因方法总结为四类:(1)基于酶的报告基因;(2)基于转运体的报告基因;(3)基于膜受体的报告基因;(4)基于胞内蛋白的报告基因(图3)。
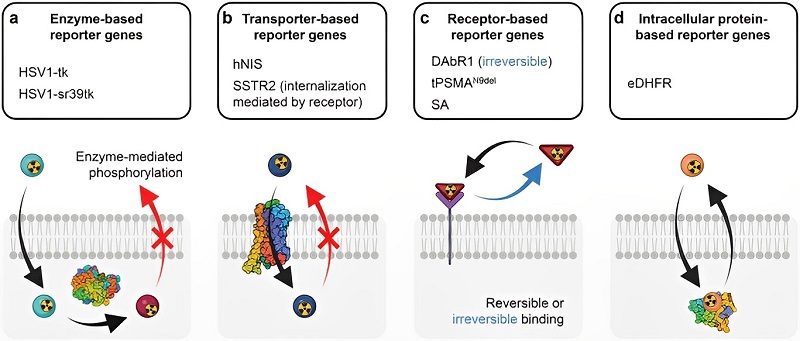
图3. 监测CAR T细胞体内活性的四类报告基因方法
T细胞的细胞杀伤性在CAR T免疫疗法中起着至关重要作用。然而,其细胞毒功能总是受到实体瘤免疫抑制微环境的负面影响,导致治疗效果降低。为监测CAR T细胞细胞毒功能,可通过两种方法:(1)T细胞的细胞毒效应成像;(2)CAR T细胞的特异性标志物。本工作讨论了两类方法的优势与不足,并认为区分CAR T细胞与其他内源性免疫细胞的细胞毒性仍然是重要挑战。
CAR T细胞疗法在实体瘤治疗方面面临多种挑战。体内监测CAR T细胞的迁移、存活和功能有助于通过优化策略改善预后。核医学成像提供了一种非侵入性、动态、可定量工具以研究CAR T细胞,包括其在体内的肿瘤可及性、瘤内活力和细胞毒功能(图4)。本工作讨论了各类技术的优势和不足之处,以及其临床转化前景。未来研究的重点包括:(1) 研究具有较低免疫原性和较高特异性的报告基因以及具有优化药物代谢动力学的放射性底物;(2) 发现高信噪比的成像新策略;(3) 探索CAR T细胞的特异性标记方法,以反映CAR T细胞体内细胞毒功能。此外,我们讨论了过继性CAR T细胞和内源性T细胞的细胞毒作用分别成像的可行性,这将有助于准确评估CAR T细胞疗法的作用。放射性成像策略在CAR T细胞的生物分布、瘤内增殖和杀伤功能进展将加速该技术的临床转化。
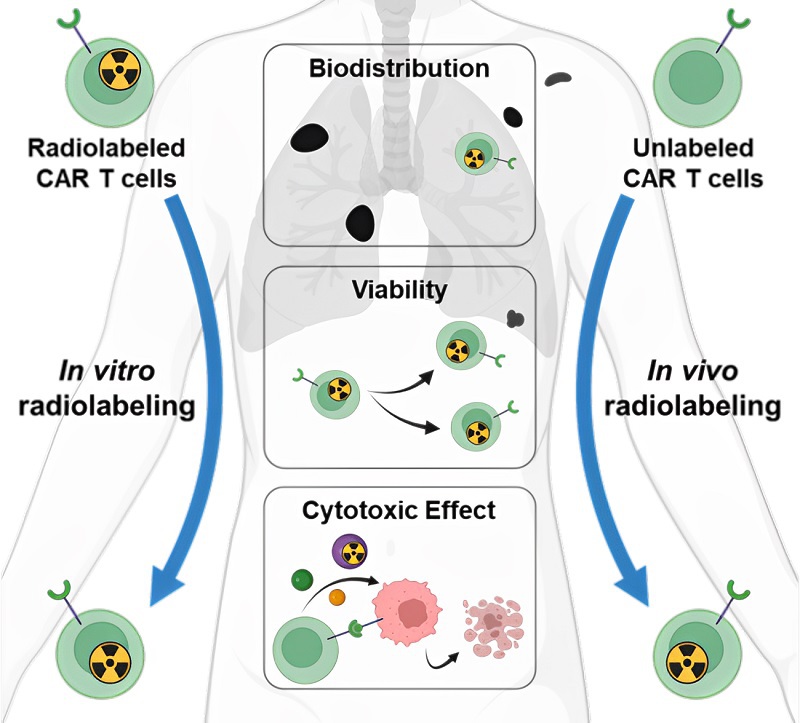
图4. 放射性成像技术评估CAR T细胞的生物分布、瘤内存活和细胞杀伤功能
复旦大学药学院博士生任明亮为该论文的第一作者。复旦大学药学院李聪教授为论文的通讯作者。复旦大学药学院博士生姚博霖、复旦大学附属闵行医院韩冰参与论文撰写。该工作获得国家自然科学基金、国家杰出青年科学基金和上海市科技重大专项的支持。
Abstract: Immunotherapy has become a mainstay of cancer therapy. Since chimeric antigen receptor (CAR) T immunotherapy achieves unprecedented success in curing hematological malignancies, the possibility of it revolutionizing the paradigm of solid tumors has aroused increasing attention. However, the restricted accessibility to tumor parenchyma, the immunosuppressive tumor microenvironment, and antigen heterogeneity of solid tumors make it difficult to replicate its success. Therefore, dynamic evaluation of CAR T cells’ tumor accessibility, intratumoral viability, and anti-tumor cytotoxicity is necessary to facilitate its translation to solid tumors. Besides, real-timely imaging above events in vivo can help evaluate therapeutic responses and optimize CAR T immunotherapy for solid tumors. Nuclear imaging, including positron emission tomography (PET) and single-photon emission computed tomography (SPECT) imaging, is frequently applied for evaluating adoptive cell therapies owing to its excellent sensitivity, high tissue penetration, and great translation potential. In addition, quantitative analysis can be performed in dynamic and noninvasive patterns. This review focuses on recent advances in PET/SPECT technologies and imaging probes in monitoring CAR T cells’ migration, viability, and cytotoxicity to solid tumors post-administration. Prospects of what should be done in the next stage to promote CAR T therapy's application in solid tumors are also discussed.
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adbi.202200293