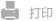癫痫是一种以神经元“兴奋-抑制”失衡、同步化异常放电为特征的脑疾病,是最常见的致死、致残性脑疾病之一。目前癫痫治疗药物靶标主要是神经元离子通道或者神经递质受体,仅可控制癫痫发作状态,无法阻断疾病进展或从根本上抑制癫痫的发生。大脑微环境的pH稳态在调控神经元电活动、神经突触可塑性、胶质细胞功能以及神经退行性病变进程中具有至关重要的意义。生理条件下,脑细胞外pH值精密维持在7.2-7.4的范围内,0.2个pH单位的微小波动即可能通过调控离子通道(如ASIC1a)和代谢酶活性显著影响神经兴奋性。但不同神经元亚群对pH变化的响应呈现差异性,例如碱性微环境会增强脑部神经元兴奋性,而化学敏感神经元则对酸性刺激呈现激活特征。因此,动态监测癫痫病灶pH波动有望为解析pH-神经兴奋性偶联机制、揭示癫痫演进规律提供关键证据。
尽管已开发出多种脑部pH监测技术,但面临不同挑战:(1)刚性电极植入侵入性高;(2)磁共振成像技术时间分辨率差;(3)荧光成像存在探针入脑效率低、难以定量等难题。因此,亟需开发能够高效入脑,并无创检测脑病灶pH变化的影像技术。表面增强拉曼散射(SERS)技术利用贵金属表面的“表面等离子体共振”效应实现单分子级信号放大。SERS探针经表面功能化修饰后其生物相容性、跨血脑屏障水平和靶向特异性能够显著提高。由于慢性神经炎症是多种神经系统疾病的共性病理特征,且炎症微环境中过氧化氢(H2O2)浓度显著升高,因此,构建H2O2响应的pH比率SERS探针不但能够特异性定位炎性病灶,还能动态监测病灶部位pH波动。
近日,复旦大学药学院王聪青年研究员、李聪教授、类脑智能科学与技术研究院王晶副教授和云南大学药学院雷祖海教授在Angewandte Chemie杂志上发表了题为:“Tandem Dual-Ratiometric SERS Probe Enables Raman Imaging of Neurological pH Fluctuations in Epilepsy”(串联双比率响应SERS探针成像癫痫病灶pH波动)的研究性论文(图1)。该工作开发了一类单光谱串联双比率响应SERS探针(RHP@AuS),实现脑部癫痫病灶pH动态监测与药物预后评估:(1)提出了一类基于树枝状聚合物的可调节性拉曼报告分子单层自组装策略,可有效抑制分子堆叠诱导的信号淬灭效应,显著提升拉曼信号强度和稳定性。(2)构建了一类可特异性富集在癫痫灶、H₂O₂开关-pH数字化读取的串联双比率型SERS探针,实现了病灶pH动态定量读取。(3)揭示了癫痫发作导致病灶局部脑区快速酸化的波动规律,提出了一种“酸碱平衡-炎症调节”的联合疗法,实现了癫痫长效持久的治疗效果。总之,该工作构建了一种高灵敏度、高特异、准确动态监测脑部疾病pH震荡的可视化工具,并为癫痫等脑疾病的精准诊疗开辟了新维度
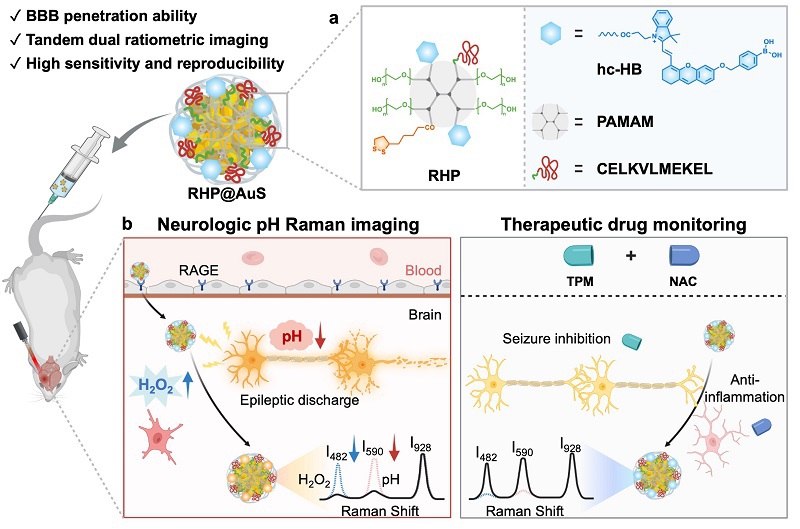
图1. 串联比率响应SERS探针跨血脑屏障成像脑部病灶pH波动并监测联合疗法药效示意图。(a)探针RHP@AuS的结构,包括一个纳米金星核和一个基于PAMAM的拉曼报告元件。PAMAM修饰上H₂O₂和pH梯次响应的半花菁分子、跨BBB的RAGE靶向肽和生物相容的亲水性聚乙二醇保护层。(b)RHP@AuS 不仅用于实时检测癫痫发作时的 pH波动,还评估协同抗炎和平衡酸碱的联合治疗策略的有效性。
在这项工作中,研究团队提出了一种基于树枝状大分子聚酰胺(PAMAM)的一步法合成策略,用于构建高灵敏、高稳定的SERS探针。与传统多步骤方法相比,该方法通过将拉曼报告分子(hc-HB)、PEG和跨血脑屏障(BBB)肽同时修饰到PAMAM表面,并利用金硫键将其锚定在金纳米颗粒上,显著简化了制备流程。实验发现,传统疏水报告分子hc-SHB直接负载会导致分子聚集,使拉曼信号降低,而引入空间位阻基团CyC(摩尔比3:1)可抑制聚集,使拉曼信号强度提升3倍。进一步研究表明,当PAMAM修饰2个hc-HB分子时,SERS信号强度达到峰值(比传统方法提高5.3倍),且探针重现性显著改善(批间变异系数从17.53%降至3.81%)。紫外-可见吸收光谱和单粒子荧光成像证实,PAMAM的共价修饰体系能有效维持报告分子的单分散状态,克服聚集引起的信号衰减。

图2. RHP@AuS的合成与表征。(a)SERS探针传统制备方法和本工作中提出的一步法制备示意图。(b)不同比例空间位阻分子调节下探针的 SERS 强度。左图:SERS 强度的统计分析。右图,相应的拉曼光谱。(c)使用传统法和本文策略构建的 SERS 探针的批次间可重复性。(d)RHP@AuS的透射电子显微镜图像。插图:RHP@AuS的流体力学直径分布。(e)AuS、RHP和RHP@AuS的紫外-可见吸收光谱。(f)AuS、RHP和RHP@AuS的SERS光谱。
接着验证了RHP@AuS对H₂O₂和pH的串联响应性及其在复杂生物环境中的适用性。HPLC-MS分析证实,探针的苯硼酸基团可被H₂O₂特异性切割。紫外-可见吸收光谱显示,H₂O₂浓度升高诱导RHP吸收峰产生浓度依赖性红移,在685-700 nm处形成新吸收峰。SERS检测表明,随着H₂O₂浓度增加,482 cm⁻¹特征峰强度(I482)显著降低,而928 cm⁻¹峰(I928)保持稳定,I928/I482与H₂O₂浓度呈线性响应,检测限低至2.40 μM。在H₂O₂激活后,随着pH升高(2.0-10.0),酚羟基去质子化导致近红外吸收峰红移至730-770 nm,同时SERS光谱中590 cm⁻¹峰(I590)强度随pH升高而增加,I928保持稳定。通过三次多项式模型校正了不同H₂O₂浓度下的pH测量精度。此外,探针在多种生物大分子、还原剂、金属离子及其他活性氧干扰下,仅H₂O₂能显著改变I928/I482比值,且pH响应不受其他物质影响。
图3. RHP@AuS的H2O2和pH体外响应性验证。(a)RHP@AuS对H2O2和pH的串联双比率响应机制示意图。(b)RHP在不同浓度H2O2中的吸收光谱。(c)RHP@AuS在不同浓度H2O2中的SERS光谱。(d)拉曼峰比I928/I590和I928/I482与H2O2浓度的拟合曲线。(e)H2O2响应后RHP在不同pH缓冲液中的吸收光谱。(f)H2O2响应后RHP@AuS在不同pH值缓冲液中的SERS光谱。(g)拉曼峰比I928/I590随pH值变化的曲线图。(h)RHP@AuS的选择性。
体外细胞实验显示,通过环噻嗪(CTZ)诱导神经元癫痫样放电后,探针检测到细胞内H2O2水平升高(I928/I482比值上升)及pH值从7.2降至6.3(I928/I590比值变化),提示癫痫放电伴随乳酸堆积和碳酸盐积累导致的酸中毒。联合应用抗癫痫药托吡酯(TPM)和ROS清除剂N-乙酰半胱氨酸(NAC)后,神经元放电减少60%,炎症水平下降93%,pH值基本恢复正常。结果表明,同时调控pH和炎症可更有效抑制癫痫发作。

图4. SERS比率探针在神经元细胞层面成像H2O2和pH。(a)小鼠原代神经元的分离、培养和拉曼成像示意图。(b)膜片钳实验记录原代神经元电生理的明场图像。(c)神经元在不同刺激下的代表性膜片钳记录。(d)100 pA电流诱导不同组细胞的动作电位数量统计。(e)拉曼共聚焦显微成像显示PBS、CTZ、CTZ+TPM、CTZ+TPM+NAC组原代神经元内源性H2O2和pH水平。伪彩色图像显示了I482、I590和I928处的拉曼信号强度。(f)细胞内H2O2浓度和pH值的定量统计。
之后系统评估了RAGE靶向SERS探针RHP@AuS跨越BBB的机制。体外Transwell实验显示,RHP@AuS的跨膜效率是非靶向探针HP@AuS的3倍,该过程可被游离多肽(CELKVLMEKEL)和RAGE抑制剂(FPS-ZM1)分别抑制66%和59%。机制研究表明,RHP@AuS主要通过能量依赖的转胞吞作用穿透BBB:4℃低温处理使其渗透性降低91%,小窝蛋白依赖的内吞抑制剂(MβCD)可减少58%的摄取,而网格蛋白依赖内吞(CPZ)和巨胞饮(CD)抑制剂无显著影响,证实其依赖RAGE介导的小窝蛋白内吞途径(图4b)。体内实验通过放射性标记(99mTc-RHP@AuS)进一步验证,正常小鼠静脉注射后,99mTc-RHP@AuS的脑部蓄积量是99mTc-HP@AuS的2倍,且病变脑区摄取更高。结果表明RHP@AuS能通过RAGE靶向转运选择性穿透BBB并在脑病变部位富集,为神经疾病活体成像提供了高穿透性、可定量化的新型探针。
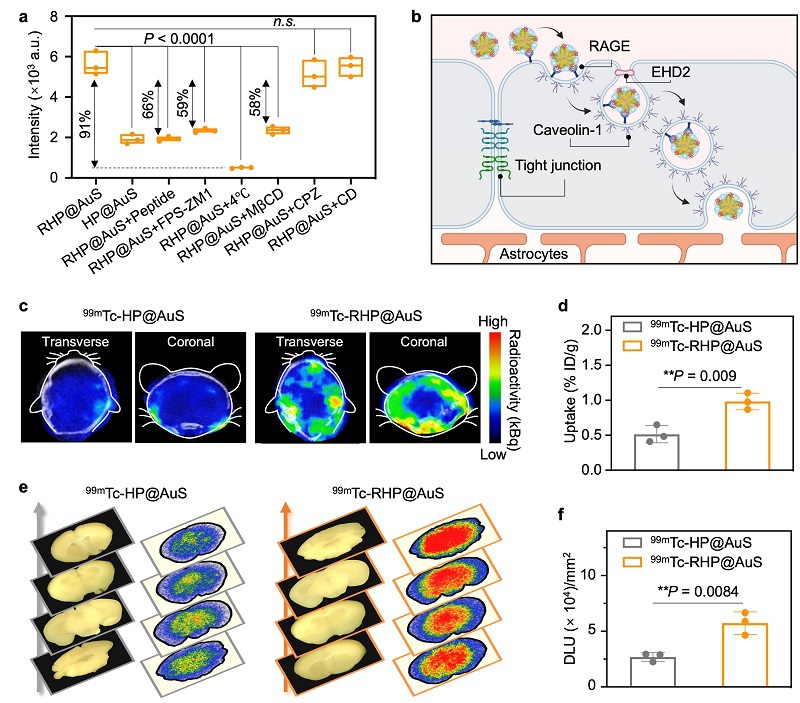
图5. RHP@AuS通过RAGE介导的主动转运跨越BBB。(a)Transwell系统经不同处理后RHP@AuS的BBB穿透效率。(b)RHP@AuS通过RAGE介导的小窝依赖性转胞吞作用穿越 BBB 的过程示意图。(c)正常小鼠静脉注射99mTc-HP@AuS或99mTc-RHP@AuS 2小时后大脑的SPECT/CT图像。(d)脑部放射性摄取的统计。(e)静脉注射99mTc-HP@AuS或99mTc-RHP@AuS 24小时后脑切片的代表性照片和自显影图像。(f)脑组织切片放射性摄取的统计分析。
之后在海藻酸(KA)诱导的癫痫模型中评估RHP@AuS在监测癫痫引起的动态pH变化中的能力。通过尾静脉注射RHP@AuS后,我们在癫痫模型中进行连续SERS成像和脑电图(EEG)记录。结果表明,RHP@AuS信号强度随剂量增加呈对数增长,在50 nmol/kg时达到平台期,确定为体内成像的最佳剂量。RHP@AuS在体内外均表现出弱背景干扰和稳定的拉曼强度,解决了传统荧光成像的组织背景干扰问题。静脉注射6小时后,通过H2O2成像定位癫痫病灶,发现I928/I482比值在病灶部位显著升高,而正常脑组织无明显变化。随着癫痫级别从2级逐渐升高到5级,病灶pH值显著降低,在强直期降至最低(约6.6),并在癫痫发作停止后逐渐恢复。Nissl染色显示,神经元死亡数量与癫痫级别呈正相关。这些结果表明,RHP@AuS可有效可视化癫痫病灶中因神经元过度兴奋引起的pH波动,为首次通过非侵入性成像技术记录癫痫期间的体内pH动态变化提供了基础。
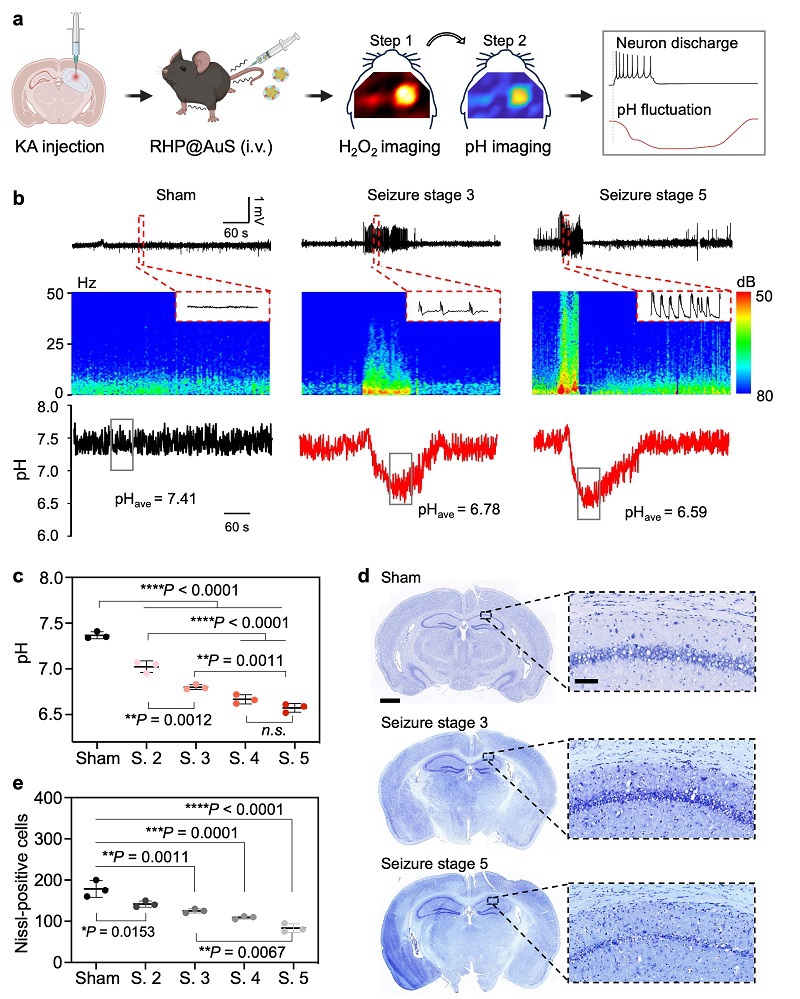
图6. RHP@AuS监测癫痫模型小鼠的pH值波动。(a)RHP@AuS在癫痫小鼠模型中原位脑SERS成像的示意图。(b)同时记录小鼠在不同癫痫发作阶段的脑电和SERS比率检测pH值波动。(c)RHP@AuS在不同癫痫发作阶段记录的平均最低pH值。(d)正常小鼠和癫痫小鼠全脑和海马CA1区的Nissl染色。(e)海马CA1区Nissl阳性细胞的定量。
在利用RHP@AuS可视化癫痫期间的pH波动的基础上,我们进一步探索了其评估治疗效果的潜力。传统抗癫痫药物主要通过调控神经元离子通道或神经递质受体来控制症状,但无法阻止癫痫进展,并伴随显著的毒副作用。癫痫发作期间,异常放电和兴奋性毒性引发神经元损伤和炎性因子的释放,导致胶质细胞激活及慢性炎症。基于神经炎症与癫痫发生的密切关系,我们提出了一种“酸碱平衡-炎症调节”的联合疗法(TPM/NAC)。EEG显示,KA诱导的癫痫模型小鼠脑活动显著增强,SERS成像表明癫痫病灶处炎症增加且pH降低。尽管TPM单药治疗暂时控制了癫痫,但停药后癫痫放电复发,病灶炎症仍然显著。而TPM/NAC治疗不仅显著降低炎症水平并提高病灶pH(I928/I482和I928/I590比值下降),在停药30天后仍维持了癫痫控制。免疫荧光染色显示,TPM/NAC显著减少海马神经元死亡(P = 0.0003),并抑制星形胶质细胞和小胶质细胞的过度激活,而TPM单药效果有限。结果表明“酸碱平衡-炎症调节”的联合疗法有效打破神经元异常放电、细胞死亡、氧化应激和神经炎症的恶性循环,为癫痫治疗提供了新角度。相比传统探针,RHP@AuS通过联合检测揭示代谢性酸中毒与神经炎症的相互作用,为癫痫病理状态和治疗效果评估提供了新方法。

图7. RHP@AuS监测癫痫小鼠的药物治疗效果。(a)癫痫小鼠模型的建立、药物治疗和原位脑SERS成像流程图。(b)癫痫小鼠注射RHP@AuS后在药物治疗前、治疗中和治疗后的SERS比率成像。(c)脑电图尖峰数量统计。(d)RHP@AuS定量的癫痫灶中H2O2浓度统计。(e)RHP@AuS定量的癫痫灶中pH值统计。(f)代表性共聚焦图像显示海马中神经元的存活、星形胶质细胞和小胶质细胞的活化。(g)同侧海马中NeuN、GFAP和Iba-1的平均荧光强度定量。(h)联合疗法通过协同炎症调节和酸碱平衡来缓解癫痫的示意图。
综上,这项研究研发了一种高灵敏、高特异、准确动态监测脑部疾病pH震荡的工具,揭示了pH震荡作为神经疾病的新型生物标志物和治疗靶点的潜力,并为癫痫等脑疾病的精准诊疗开辟了新维度。主要创新点在于:
(1)探针设计创新:①集成H₂O₂激活开关与pH响应型近红外拉曼分子,实现单分子双比率响应,利用自校准拉曼峰准确定量H₂O₂和pH;②通过聚酰胺骨架结构显著提升拉曼信号强度和稳定性,同时避免信号淬灭效应,实现一步法制备,简化流程并具良好重复性;③靶向晚期糖基化终产物受体的多肽修饰,赋予探针高效、选择性脑部递送能力。
(2)病理机制创新:首次通过非侵入性成像技术捕获癫痫发作期间局部脑区快速酸化至最低pH 6.6,并观察到异常放电停止后pH逐渐恢复的动态过程。
(3)治疗策略创新:提出“酸碱平衡-炎症调节”的联合疗法,协同抑制神经元痫样放电和改善病灶局部炎性微环境,为癫痫长效持久治疗提供实时分子影像工具与新策略。
复旦大学药学院博士生赵静、复旦大学附属华山医院博士生陈运灿、复旦大学类脑研究院硕士生汤于睿为本文共同第一作者。复旦大学药学院王聪青年研究员、复旦大学药学院李聪教授、云南大学药学院雷祖海教授和复旦大学类脑研究院王晶教授为本文共同通讯作者。该工作获得国家科技部重点研发项目,国家杰出青年科学基金,国家自然科学基金项目,上海市科委计划项目和上海市科技项目的支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202504822