胶质瘤占所有原发性恶性脑肿瘤的80%以上,而胶质母细胞瘤(GBM)是恶性程度最高的胶质瘤。异柠檬酸脱氢酶(IDH)是决定GBM预后的最关键基因之一。IDH野生型(IDH1WT)GBM占总病例90%左右,中位生存期约为13个月,显著低于IDH突变型(IDH1MUT)GBM的中位生存期(33个月)。包括免疫检查点治疗在内的免疫治疗是肿瘤治疗新策略,但临床结果显示该策略并未显著改善IDH1WT GBM患者预后。其主要原因可能是胶质瘤肿瘤免疫抑制微环境降低瘤内免疫响应。因此,免疫抑制微环境再平衡对提高IDH1WT GBM患者免疫治疗预后具有重要意义。
近日,复旦大学药学院李聪教授、附属华山医院陈亮主任医师以及中国科学院上海药物研究院黄锐敏研究员联合研究团队,在Oncoimmunology杂志上发表了题为:“Reprogramming the immunosuppressive microenvironment of IDH1 wild-type glioblastoma by blocking Wnt signalling between microglia and cancer cells(阻断小胶质细胞和IDH野生型癌细胞间的Wnt信号通路重建胶质瘤免疫微环境)的论文。该工作提出通过调控小胶质细胞表型再平衡,改善脑疾病免疫炎性微环境,提高胶质瘤预后的新策略。发现了Wnt/β-catenin信号通路在维持肿瘤免疫抑制微环境中的重要作用。抑制Wnt/β-catenin信号通路能够切断抑炎表型小胶质细胞和IDH1WT胶质瘤细胞二者间联络,激活胶质瘤免疫响应,延长小鼠生存期。
本工作首先通过CGGA数据库,发现与IDH1MUT 胶质瘤患者相比,IDH1WT胶质瘤患者中多个免疫抑制基因和Wnt/β-catenin信号通路关键基因—CTNNB1基因均高表达(图1)。这表明IDH1WT GBM中CTNNB1基因与其免疫抑制微环境具有一定的相关性。
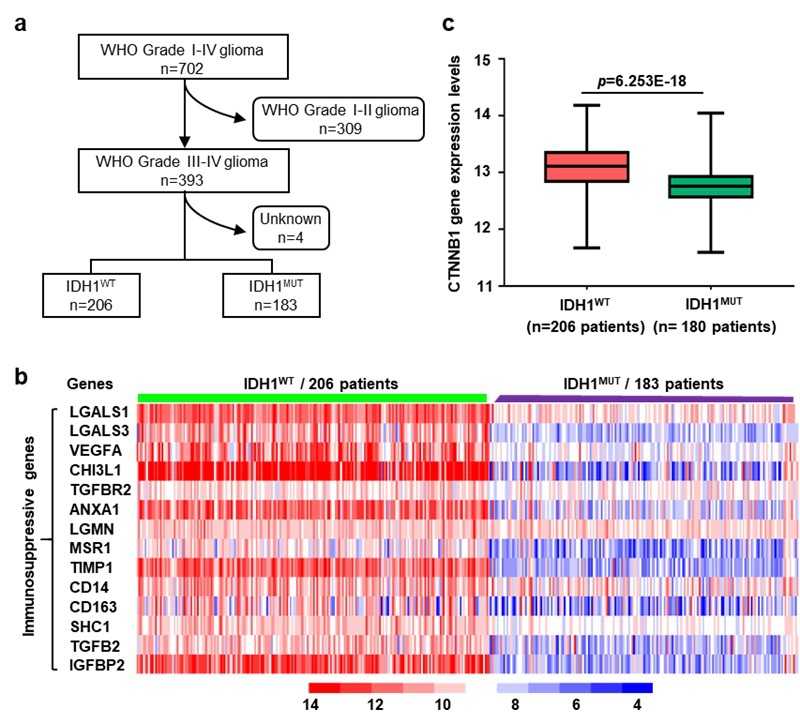
图1. IDH1WT和IDH1MUT胶质瘤患者中免疫抑制基因与CTNNB1基因表达情况。(a)胶质瘤患者数据筛选流程图。(b)IDH1WT胶质瘤患者中免疫抑制基因高表达。(c)IDH1WT胶质瘤患者中CTNNB1基因高表达。
由于小胶质细胞是胶质瘤免疫微环境主要的免疫细胞,本工作分析了IDH1WT GBM临床样本和种植IDH1WT GL261小鼠动物模型上抑炎型小胶质细胞和β-catenin蛋白的表达情况。结果发现,IDH1WT GBM临床样本和IDH1WT GL261荷瘤小鼠模型上抑炎型小胶质细胞和β-catenin蛋白均高表达(图2)。这表明IDH1WT GBM中抑炎型小胶质细胞与β-catenin蛋白水平可能存在一定的相关性。
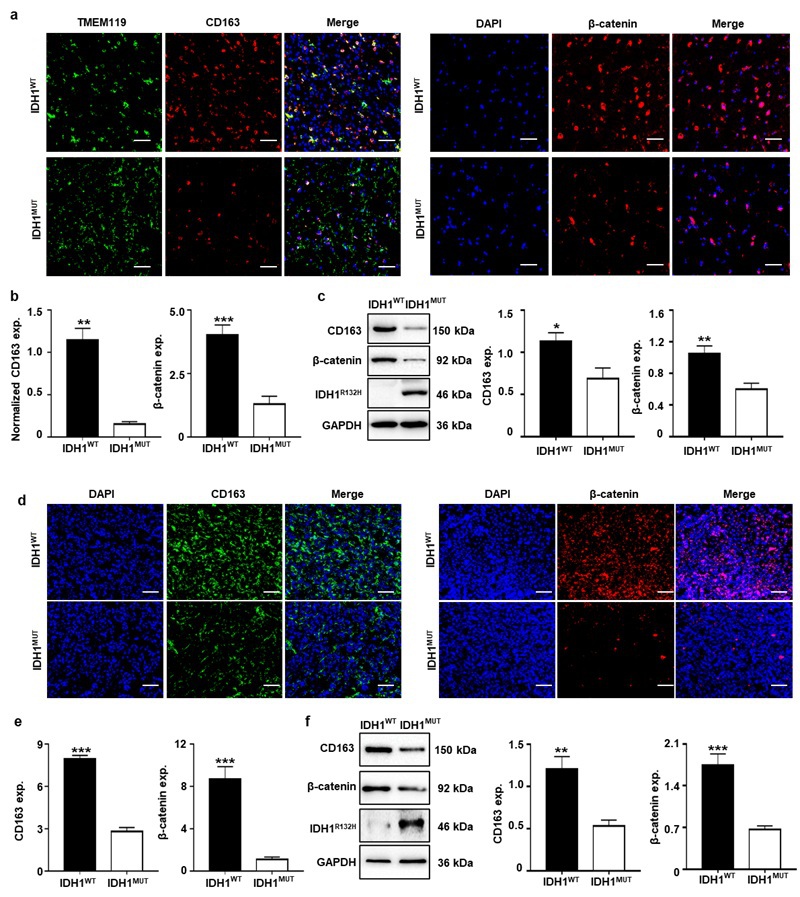
图2. IDH1WT GBM中抑炎型小胶质细胞和β-catenin蛋白表达具有相关性。(a,b)IDH1WT GBM临床样本中小胶质细胞特异性标志物 TMEM119(绿色)、抑炎表型小胶质细胞标志物 CD163(红色)以及 β-catenin蛋白(红色)的免疫荧光染色图及其统计图。(c)上述临床胶质瘤样本中CD163蛋白、β-catenin蛋白的Western blot结果图及其统计图。(d,e)IDH1WT GL261小鼠胶质瘤样本中抑炎型小胶质细胞标志物 CD163(绿色)以及 β-catenin蛋白(红色)的免疫荧光染色图及其统计图。(f)上述小鼠胶质瘤样本中CD163蛋白、β-catenin蛋白的Western blot结果图及其统计图。GAPDH作为内参。其中IDH1MUT GBM样本作为对照。细胞核(DAPI,蓝色),比例尺 = 50 μm。
为进一步研究抑炎型小胶质细胞与β-catenin蛋白之间的联系,本工作提取了鼠源原代小胶质细胞,并用IDH1WT GL261细胞的条件培养液(CM-WT)、IDH1MUT GL26细胞的条件培养液(CM-MUT)或正常的F12完全培养液(NM)处理小胶质细胞(图3a)结果发现,IDH1WT GL261肿瘤细胞培养液具有使原代小胶质细胞向抑炎型极化的能力,而且作用后的小胶质细胞Wnt/β-catenin通路被激活(图3b-d)。
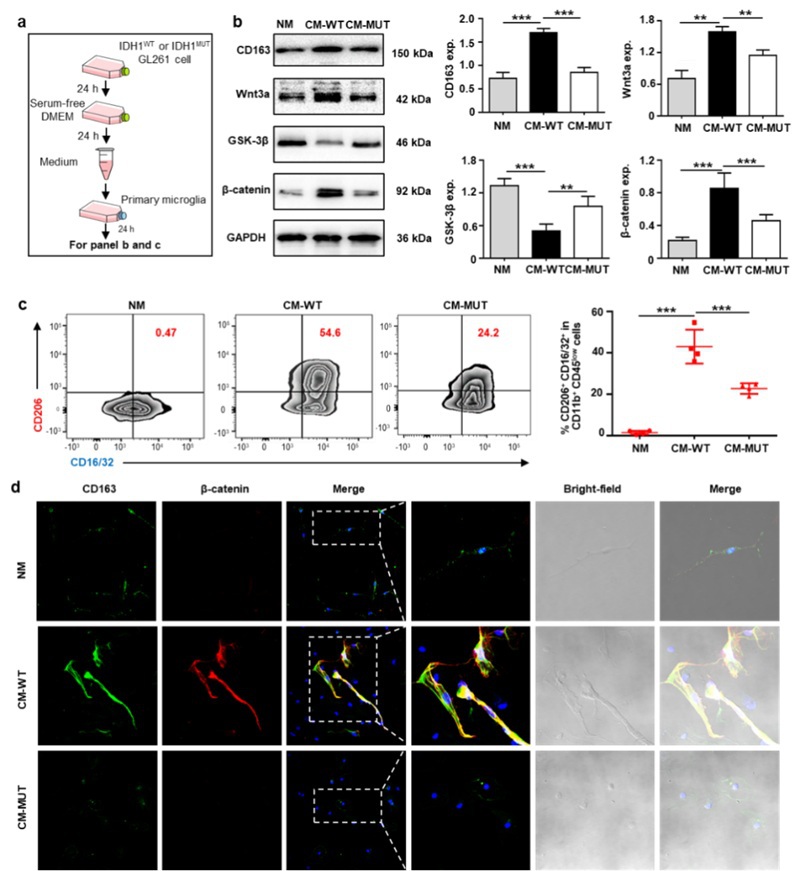
图3. IDH1WT癌细胞培养液激活了原代小胶质细胞Wnt/β-catenin通路并诱导其向抑炎表型极化。(a)用IDH1WT或IDH1MUT GL261胶质瘤细胞衍生条件培养液处理原代小胶质细胞的示意图。原代小胶质细胞经IDH1WT细胞(CM-WT)、IDH1MUT细胞(CM-MUT)的条件培养液或正常的F12完全培养液(NM)处理24 h后,进行Western blot实验。(b)经上述条件培养液处理后小胶质细胞中CD163,Wnt3a,GSK-3β和β-catenin蛋白的Western blot结果图及其统计图。(c)经上述条件培养液处理后小胶质细胞的流式分析结果图。(d)经上述条件培养液处理后小胶质细胞的免疫荧光染色结果图。
为进一步考察Wnt/β-catenin通路在肿瘤细胞和小胶质细胞之间的作用,本工作首先将Wnt/β-catenin通路抑制剂Wnt-C59加入到IDH1WT GL261细胞中,发现Wnt-C59抑制剂不但降低了IDH1WT GL261细胞增殖的能力而且降低了其诱导小胶质细胞向抑炎表型转化的能力。随后,该工作把Wnt-C59加入到抑炎型小胶质细胞中,结果发现,Wnt-C59抑制剂在抑制抑炎表型小胶质细胞Wnt/β-catenin通路的同时,降低了其促进IDH1WT GL261细胞迁移作用(图4)。
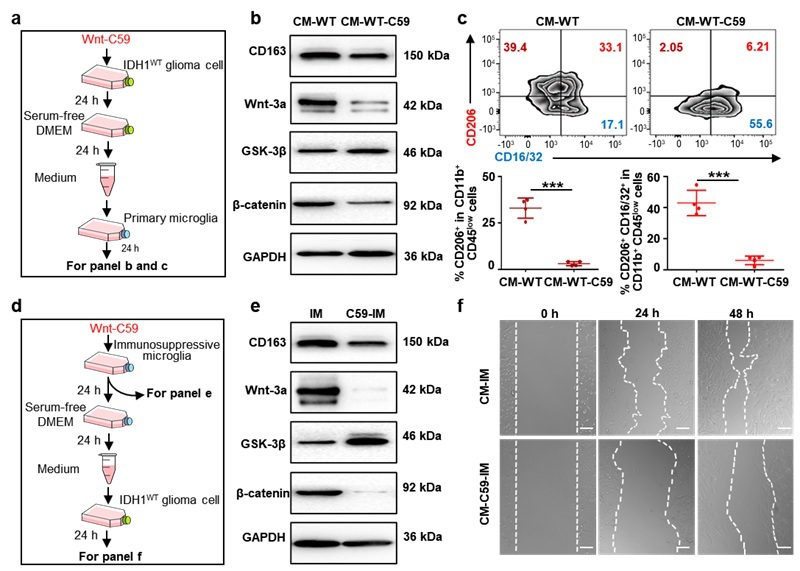
图4. Wnt抑制剂阻碍小胶质细胞抑炎极化及癌细胞迁移。(a)用Wnt-C59处理的IDH1WT GL261胶质瘤细胞培养液或未经处理条件培养液作用于原代小胶质细胞的示意图。(b)上述条件培养液处理后的小胶质细胞中CD163,Wnt3a,GSK-3β和β-catenin蛋白的Western blot结果图。(c)经上述条件培养液处理后小胶质细胞的流式分析结果图。(d)抑炎型小胶质细胞经Wnt-C59处理后实验操作的示意图。(e)抑炎型小胶质细胞经Wnt-C59处理24 h后,CD163,Wnt3a,GSK-3β和β-catenin蛋白的Western blot结果图。(f)IDH1WT GL261肿瘤细胞经Wnt-C59(CM-C59-IM)和未经Wnt-C59(CM-IM)处理后的抑炎型小胶质细胞培养液刺激24 h后的划痕实验结果图。
活体PET成像实验发现,给予IDH1WT GL261小鼠模型Wnt-C59抑制剂后,小鼠胶质瘤中神经炎症标志物TSPO受体靶向PET探针[18F]DPA-714的SUV值显著升高,促炎型小胶质细胞、CD8+ T细胞的含量显著增加,而Treg细胞的含量显著降低(图5)。同时,小鼠胶质瘤体积生长率降低,生存期显著增加。
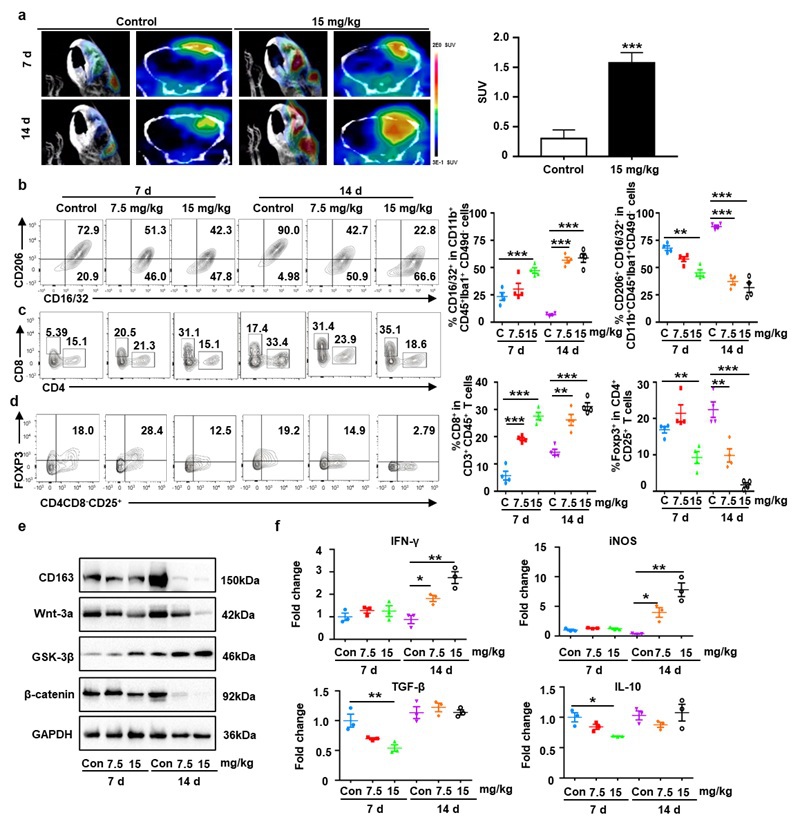
图5.Wnt/β-catenin通路抑制剂重新激活胶质瘤模型的免疫应答。(a)左侧是代表性的[18F]DPA714在IDH1WT GL261小鼠模型脑部的PET/CT图像。右侧是IDH1WT GL261小鼠经静脉注射[18F]DPA714示踪剂0.5 h后,小鼠胶质瘤内SUV值的统计图。(b-d)种植IDH1WT GL261细胞的小鼠动物模型经PBS及高低剂量Wnt/β-catenin通路抑制剂(Wnt-C59)分别处理7 d、14 d后肿瘤内促炎型小胶质细胞(CD16/32+)、抑炎型小胶质细胞(CD16/32+ CD206+)、CD8+ T淋巴细胞(CD3+CD8+)以及Treg细胞(CD4+ Foxp3+ CD8- CD25+)含量的流式分析结果图。(e,f)种植IDH1WT GL261细胞的小鼠动物模型经PBS及高低剂量Wnt/β-catenin通路抑制剂(Wnt-C59)分别处理7 d、14 d后肿瘤内CD163,Wnt3a,GSK-3β和β-catenin蛋白的表达以及IFN-γ mRNA,iNOS mRNA,TGF-β mRNA和IL-10 mRNA的表达。
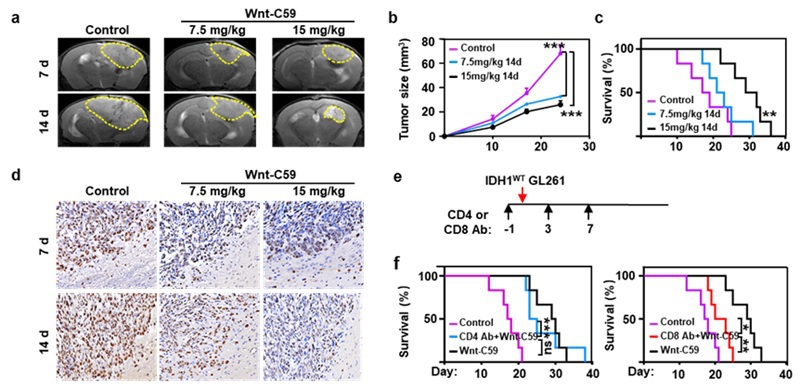
图6. Wnt抑制剂抑制IDH1WT GL261胶质瘤模型生长并提高预后。(a-d)种植IDH1WT GL261细胞的小鼠动物模型经PBS及高低剂量Wnt/β-catenin通路抑制剂(Wnt-C59)分别处理7 d、14 d后脑部的肿瘤大小变化及其胶质瘤中Ki67蛋白的表达情况。(e)上述小鼠模型经CD4 Ab或CD8 Ab处理的时间示意图。(f)经CD4 Ab+15 mg/kg Wnt-C59(蓝色线)、CD8 Ab+15 mg/kg Wnt-C59(红色线)、15 mg/kg Wnt-C59(黑色线)及PBS(紫色线)处理的IDH1WT小鼠胶质瘤模型的Kaplan-Meier生存曲线。
复旦大学药学院博士研究生范丹丹与复旦大学附属华山医院的岳琪博士为共同第一作者。复旦大学药学院李聪教授、复旦大学附属华山医院神经外科陈亮教授以及上海药物研究所黄锐敏研究员为本文的共同通讯作者。该研究获得了国家自然基金委,上海市科学技术委员会等项目支持。
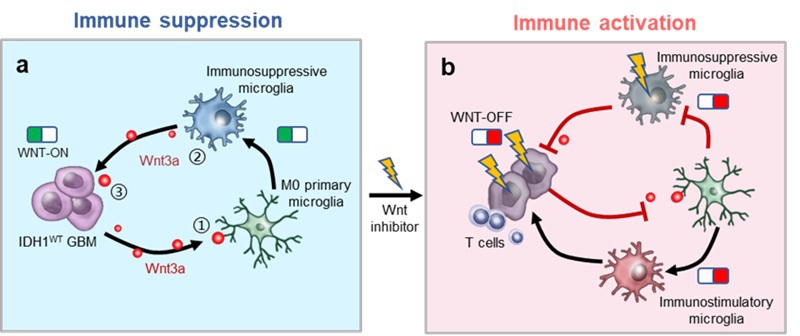
抑制Wnt/β-catenin通路切断抑炎型小胶质细胞和胶质瘤细胞间联络,激活免疫响应
原文链接:https://www.tandfonline.com/doi/full/10.1080/2162402X.2021.1932061